题目内容
17.下表是部分短周期元素在周期表中的相对位置关系,试完成以下题目:| 族 短周期 | ⅠA | ||||||
| ① | |||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ |
(2)写出元素⑦在周期表中的位置为第三周期第ⅡA族.
(3)写出元素⑧的单质与NaOH溶液反应的化学方程式2Al+2H2O+2NaOH═2NaAlO2+3H2↑.
(4)某元素的单质在与大气的平流层中能吸收紫外线,被称为地球生物的“保护伞”,则该元素在表中的序号为⑤,该元素的名称为臭氧
(5)元素⑩的单质是一种污染大气的气体,试写出在实验室中吸收该气体的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
分析 元素在周期表中的相对位置关系可知,①为H、②为Na、③为Be、④为B、⑤为N、⑥为O、⑦为Mg、⑧为Al、⑨为S、⑩为Cl元素,然后结合元素周期律知识进行解答.
解答 解:元素在周期表中的相对位置关系可知,①为H、②为Na、③为Be、④为B、⑤为O、⑥为N、⑦为Mg、⑧为Al、⑨为S、⑩为Cl元素,
(1)表中元素⑤的氯化物的化学式为NCl3,NCl3在水溶液中发生水解反应生成亚硝酸和氯化氢,溶液呈酸性,
故答案为:NCl3;酸;
(2)元素⑦为Mg,原子序数为12,位于周期表中第三周期第ⅡA族,
故答案为:第三周期第ⅡA族;
(3)元素⑧为Al,金属铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
(4)某元素的单质在与大气的平流层中能吸收紫外线,被称为地球生物的“保护伞”,则该物质为氧元素的单质臭氧,在表中的序号为⑤,
故答案为:⑤;臭氧;
(5)元素⑩的单质是一种污染大气的气体,该单质为氯气,在实验室中常用氢氧化钠溶液吸收,反应的离子方程式为:,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了考查了位置、结构与性质关系的综合应用,题目难度中等,明确原子结构与元素周期表结构为解答关键,注意掌握元素周期律内容,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.对于反应4C0(g)+2N02(g)?N2(g)+4C02(g),以下化学反应速率的表示中,所表示反应速率最慢的是( )
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
8.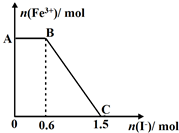 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
5.下列各组离子在指定溶液中能大量共存的是( )
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加入Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:NH4+、Ba2+、HCO3-、Br- |
12.下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| A | 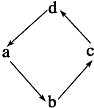 | N2 | NO2 | NO | HNO3 |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
8.可能呈+2价的金属元素是( )
| A. | 核电荷数为13的元素 | B. | 质量数为35,中子数为18的元素 | ||
| C. | 质量数为24,中子数为12的元素 | D. | M层比L层电子数少6个电子的元素 |
 CH2=CH-CH=CH2、=-=.
CH2=CH-CH=CH2、=-=. ,则它的分子式为C9H14O,其官能团为羟基和碳碳双键,它属于脂环化合物(填“芳香化合物”或“脂环化合物”)
,则它的分子式为C9H14O,其官能团为羟基和碳碳双键,它属于脂环化合物(填“芳香化合物”或“脂环化合物”)