题目内容
16.下列说法正确的是(NA表示阿伏加德罗常数)( )| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 23g钠在化学反应中得到的电子数为NA |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.氦气为单原子分子,据此判断;
C.氯气为双原子分子,依据n=$\frac{m}{M}$计算其物质的量,然后计算其原子数即可;
D.钠为活泼金属元素,在化学反应中失去电子.
解答 解:A.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,故分子个数小于0.5NA个,故A错误;
B.氦气为单原子分子,1mol氦气含有原子数目为NA,故B正确;
C.71gCl2的物质的量n=$\frac{71g}{71g/mol}$=1mol,故含有原子数目为2NA,故C错误;
D.钠在化学反应中表现强还原性,失去电子,不是得到电子,故D错误,
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
9.下列物质不会造成水污染的是( )
| A. | O2 | B. | 酸雨 | C. | 石油 | D. | 含磷洗涤剂 |
7.对于反应4C0(g)+2N02(g)?N2(g)+4C02(g),以下化学反应速率的表示中,所表示反应速率最慢的是( )
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
4.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用托盘天平称量25.20 g NaCl | |
| D. | 用25ml碱式滴定管量取21.70 mLNaOH溶液 |
11.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 食盐水 | B. | 浑浊的石灰水 | C. | 盐酸 | D. | 氢氧化铁胶体 |
1.向含有2molHNO3的稀溶液中加入3mol铜,充分反应后产生的气体在标准状况下的体积约为( )
| A. | 89.6L | B. | 44.8L | C. | 22.4L | D. | 11.2L |
8.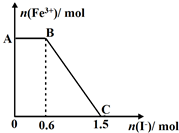 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
5.下列各组离子在指定溶液中能大量共存的是( )
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加入Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:NH4+、Ba2+、HCO3-、Br- |