题目内容
3.20mL0.02mol•L-1 KMnO4溶液恰好与20mL0.05mol•L-1 Na2SO3溶液完全反应,则Mn在还原产物中的化合价是:(提示:Na2SO3在反应中被氧化成Na2SO4)( )| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
分析 由信息可知,Mn元素的化合价降低,S元素的化合价升高,结合电子守恒计算.
解答 解:设Mn在还原产物中的化合价为x,
由电子守恒可知,
0.02L×0.2mol/L×(7-x)=0.02L×0.05mol/L×(6-4),
解得x=+2,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒应用,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
14.下列有关水的说法正确的是( )
| A. | 饮用水越纯净越好 | B. | 水是一种很好的溶剂 | ||
| C. | 没有污染的水就是纯净水 | D. | 水在人体内没有调节体温的作用 |
11.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 食盐水 | B. | 浑浊的石灰水 | C. | 盐酸 | D. | 氢氧化铁胶体 |
18.某无色透明的强酸性溶液中,可能大量存在的离于组是( )
| A. | K+、SO42-、CO32- | B. | Al3+、Na+、NO3- | C. | NH4+、OH-、SO32- | D. | Ag+、Cu2+、HCO3- |
8.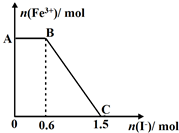 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
15.如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图象的是( )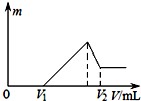

| A. | 向硫酸溶液中加入氢氧化钡溶液 | |
| B. | 向碳酸氢钠溶液中加入氯化钙 | |
| C. | 向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 向氯化铝溶液中加入过量氢氧化钠溶液 |
12.下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| A | 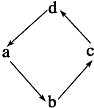 | N2 | NO2 | NO | HNO3 |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
 3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式
3)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式