题目内容
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |
考点:化学方程式的有关计算,硝酸的化学性质
专题:
分析:发生Zn+HNO3→Zn(NO3)2+NxOy↑+H2O中,Zn与HNO3的物质的量之比为5:12,则Zn为5mol失去电子与2mol硝酸得电子相等,以此来计算.
解答:
解:发生反应生成Zn(NO3)2,体现硝酸的酸性,则消耗的Zn与HNO3的物质的量之比为5:12,设物质的量分别为5mol、12mol,
Zn为5mol失去电子与2mol硝酸得电子相等,设还原产物中N元素的化合价为n,由电子守恒可知,
5mol×(2-0)=2mol×(5-n),
解得n=0,即还原产物氮气,
故选C.
Zn为5mol失去电子与2mol硝酸得电子相等,设还原产物中N元素的化合价为n,由电子守恒可知,
5mol×(2-0)=2mol×(5-n),
解得n=0,即还原产物氮气,
故选C.
点评:本题考查氧化还原反应的计算,为高频考查,侧重分析与计算能力的考查,注意电子守恒的应用,注意发生4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O时还原产物中N元素的平均化合价为0,但不符合此题信息中消耗的Zn与HNO3的物质的量之比为5:12,题目难度中等.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
下列实验操作中,正确的是( )
| A、配制5%NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 |
| B、过滤时可用温度计代替玻璃棒 |
| C、分液时球形和梨形分液漏斗的活塞可以放在相同的位置 |
| D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
已知CH4、H2O和NH3的物质的量均为1mol,下列说法不正确的是( )
| A、所含分子数之比为1:1:1 |
| B、所含氢原子数之比为4:2:3 |
| C、摩尔质量之比为1:1:1 |
| D、质量之比为16:18:17 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |
下列说法正确的是( )
A、按系统命名法,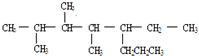 命名为2,3,4-三甲基-5-丙基庚烷 命名为2,3,4-三甲基-5-丙基庚烷 |
| B、邻羟基苯甲醛和对羟基苯甲醛是同分异构体,但邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 |
C、塑化剂的种类很多,其中一种塑化剂的结构简式如图所示.可知该塑化剂该塑化剂在人体内会彻底水解产生2种有机物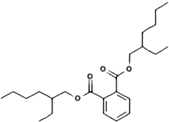 |
D、用甘氨酸(HN2-CH2-COOH)和丙氨酸(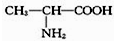 )缩合最多可形成3种二肽 )缩合最多可形成3种二肽 |
 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.