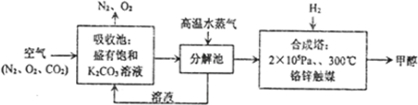
题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
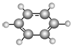
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |
考点:阿伏加德罗常数
专题:
分析:A、根据在H2SO4中,H+和SO42-的物质的量之比为2:1来分析;
B、从水溶液中含有水分子分析判断;
C、标况下,CHCl3是液态;
D、依据氢氧根离子的放电反应式计算.
B、从水溶液中含有水分子分析判断;
C、标况下,CHCl3是液态;
D、依据氢氧根离子的放电反应式计算.
解答:
解:A、2LpH=1的H2SO4溶液中,H+的物质的量n=CV=0.1mol/L×2L=0.2mol,由于在H2SO4中,H+和SO42-的物质的量之比为2:1,故SO42-的物质的量为0.1mol,个数为0.1NA个,故A错误;
B、300mL2mol/L蔗糖溶液中含蔗糖分子0.6mol,但溶液中还有水分子,故B错误;
C、标况下,CHCl3是液态,故C错误;
D、氢氧根离子的放电反应式为 4OH-=4e-+2H2O+O2↑,所以1molOH-参与电解,反应过程中转移的电子数为NA,故D正确;
故选D.
B、300mL2mol/L蔗糖溶液中含蔗糖分子0.6mol,但溶液中还有水分子,故B错误;
C、标况下,CHCl3是液态,故C错误;
D、氢氧根离子的放电反应式为 4OH-=4e-+2H2O+O2↑,所以1molOH-参与电解,反应过程中转移的电子数为NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |
对下列氧化还原反应中转移电子数的判断,不正确的是( )
| A、H2S+H2SO4(浓)=S↓+SO2↑+2H2O:6e- |
| B、3Cl2+6KOH5KCl+KClO3+3H2O:5e- |
| C、2Na2O2+2H2O=4NaOH+O2↑:2e- |
| D、2H2S+SO2=3S+2H2O:4e- |
下列结论正确的是( )
| A、向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、足量铜与含1mol溶质的浓硫酸反应,可生成0.5molSO2 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| D、15.6g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023 |
下列实验设计及其对应的离子反应方程式正确的是( )
A、用惰性电极电解MgCl2 溶液:2Cl-+2H2O
| ||||
| B、用浓盐酸酸化的高锰酸钾溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| C、向NH4Al(SO4)2溶液中逐滴加入过量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3?H2O | ||||
| D、向澄清石灰水中滴加同浓度的少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
 ;
;