题目内容
 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.(1)提出假设
①该反应的气体产物是
②该反应的气体产物是
③该反应的气体产物是
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的化学方程式:
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取4.80g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气,冷却至室温,称得硬质玻璃管和固体总质量为53.12g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为3.00g.
步骤②、④中都分别通入N2,其作用分别为:
步骤②
步骤④
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
(6)实验优化
该学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据假设①可以得出假设②、③的内容;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)根据前后两次通入氮气的时间和减小实验误差角度来分析;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)①根据氢氧化钙和氢氧化钡的溶解度及生成沉淀的质量大小来思考;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)根据前后两次通入氮气的时间和减小实验误差角度来分析;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)①根据氢氧化钙和氢氧化钡的溶解度及生成沉淀的质量大小来思考;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答:
解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物,故答案为:CO;CO2;CO2和CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为NaNO2+NH4Cl
N2↑+NaCl+H2O,
故答案为:NaNO2+NH4Cl
N2↑+NaCl+H2O;
(4)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气;最后确保完全吸收,反应后还要赶出所有的CO2,
故答案为:为了排尽空气;是将生成CO2气体全部赶入澄清石灰水中,使CO2被充分吸收;
(5)4.80g氧化铁的物质的量为=
=0.03mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=
=0.03mol,m(CO2)=0.03mol×44g/mol=1.32g,
反应后硬质玻璃管和固体总质量变化为48.48g+4.800g+2.00g-53.12g=2.16g,大于1.32g,则生成其气体为CO2、CO的混合物,混合气体中含有CO质量为:2.16g-1.32g=0.84g,CO的物质的量为:
=0.03mol,所以CO、CO2的混合气体物质的量比为1:1,所以方程式为:Fe2O3+2C
CO↑+CO2↑+2Fe,
故答案为:Fe2O3+2C
CO↑+CO2↑+2Fe;
(6)①将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,称量时相对误差小,
故答案为:氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理,故答案为:在装置后加一个点燃的酒精灯除尾气CO或增加一尾气处理装置.
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为NaNO2+NH4Cl
| ||
故答案为:NaNO2+NH4Cl
| ||
(4)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气;最后确保完全吸收,反应后还要赶出所有的CO2,
故答案为:为了排尽空气;是将生成CO2气体全部赶入澄清石灰水中,使CO2被充分吸收;
(5)4.80g氧化铁的物质的量为=
| 4.80g |
| 160g/mol |
则n(CO2)=n(CaCO3)=
| 3.00g |
| 100g/mol |
反应后硬质玻璃管和固体总质量变化为48.48g+4.800g+2.00g-53.12g=2.16g,大于1.32g,则生成其气体为CO2、CO的混合物,混合气体中含有CO质量为:2.16g-1.32g=0.84g,CO的物质的量为:
| 0.84g |
| 28g/mol |
| ||
故答案为:Fe2O3+2C
| ||
(6)①将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,称量时相对误差小,
故答案为:氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理,故答案为:在装置后加一个点燃的酒精灯除尾气CO或增加一尾气处理装置.
点评:本题是一道综合型的实验知识题目,考查学生分析和解决问题的能力,方程式的书写难度较大,注意利用数据计算.

练习册系列答案
相关题目
下列有关表述正确的是( )
A、质量数为16的氧原子:
| ||||
| B、纯碱的化学式:NaHCO3 | ||||
C、Mg2+结构示意图: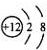 | ||||
D、铁丝在氯气中燃烧的化学方程式:Fe+Cl2
|
下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
| A、用氯气和消石灰制漂白粉 |
| B、用氢气和氮气合成氨 |
| C、用铁矿石炼铁 |
| D、用石灰石生产生石灰 |
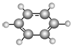
下列关于如图所示有机物的说法中,不正确的是( )


| A、该物质能发生缩聚反应 |
| B、该物质的核磁共振氢谱上共有7个峰 |
| C、该物质能与浓溴水发生反应 |
| D、1mol该物质完全反应最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |

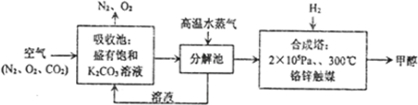
 ;
;