题目内容
已知CH4、H2O和NH3的物质的量均为1mol,下列说法不正确的是( )
| A、所含分子数之比为1:1:1 |
| B、所含氢原子数之比为4:2:3 |
| C、摩尔质量之比为1:1:1 |
| D、质量之比为16:18:17 |
考点:物质的量的相关计算
专题:计算题
分析:A.分子数目之比等于物质的量之比;
B.结合分子含有原子数目计算各物质含有氢原子总物质的量;
C.摩尔质量在数值上等于其摩尔质量,进而计算摩尔质量之比;
D.根据m=nM计算质量之比.
B.结合分子含有原子数目计算各物质含有氢原子总物质的量;
C.摩尔质量在数值上等于其摩尔质量,进而计算摩尔质量之比;
D.根据m=nM计算质量之比.
解答:
解:A.根据N=nNA可知,物质的量均为1mol的CH4、H2O和NH3的分子数目之比为1:1:1,故A正确;
B.物质的量均为1mol的CH4、H2O和NH3的含有氢原子总物质的量分别为4mol、2mol、3mol,三者含有原子数目之比为4:2:3,故B正确;
C.CH4、H2O和NH3的摩尔质量之比为16g/mol:18g/mol:17g/mol=16:18:17,故C错误;
D.根据m=nM可知,物质的量均为1mol的CH4、H2O和NH3的质量之比为16g/mol:18g/mol:17g/mol=16:18:17,故D正确,
故选C.
B.物质的量均为1mol的CH4、H2O和NH3的含有氢原子总物质的量分别为4mol、2mol、3mol,三者含有原子数目之比为4:2:3,故B正确;
C.CH4、H2O和NH3的摩尔质量之比为16g/mol:18g/mol:17g/mol=16:18:17,故C错误;
D.根据m=nM可知,物质的量均为1mol的CH4、H2O和NH3的质量之比为16g/mol:18g/mol:17g/mol=16:18:17,故D正确,
故选C.
点评:本题考查物质的量有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g,滤液质量比原石灰水减少5.8g,该有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
下列关于如图所示有机物的说法中,不正确的是( )


| A、该物质能发生缩聚反应 |
| B、该物质的核磁共振氢谱上共有7个峰 |
| C、该物质能与浓溴水发生反应 |
| D、1mol该物质完全反应最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
下列说法中,不正确的是( )
| A、反应热指的是反应过程中吸收或放出的热量 |
| B、原电池的负极发生氧化反应 |
| C、伴随能量变化的不一定是化学变化 |
| D、电解池的阳极发生氧化反应 |
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、6.0g金刚石中含有的共价键数为NA |
| B、56g铁粉与酸反应失去的电子数一定为0.2 NA |
| C、1 mol?L-1AlCl3溶液中含有3NA个Cl |
| D、标况下,11.2LSO3所含的分子数为0.5NA |
下列结论正确的是( )
| A、向氯化铝溶液中滴加过量氨水,反应的离子方程式是:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、足量铜与含1mol溶质的浓硫酸反应,可生成0.5molSO2 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| D、15.6g过氧化钠与足量二氧化碳充分反应,转移电子数为1.204×1023 |
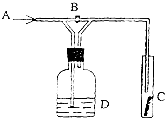 如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )
如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )| A、浓硫酸 |
| B、饱和食盐水 |
| C、浓氢氧化钠溶液 |
| D、氢氧化钙悬浊液 |