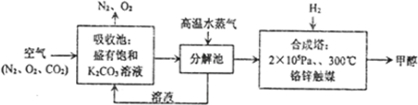
题目内容
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C-比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子.回答下列问题:
(1)与C同族的上一周期元素的气态氢化物的稳定性比HC的 (填“强”或“弱”);
与C同族的上一周期元素的气态氢化物的沸点比HC的 (填“高”或“低”);
(2)元素D的最高价氧化物的电子式为 ,D的气态氢化物的二氯代物有 种结构.
(3)用电子式表示A、C形成化合物的过程:
(4)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是 (用化学式填写),负极电极反应是 .
(1)与C同族的上一周期元素的气态氢化物的稳定性比HC的
与C同族的上一周期元素的气态氢化物的沸点比HC的
(2)元素D的最高价氧化物的电子式为
(3)用电子式表示A、C形成化合物的过程:
(4)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素,B元素原子核外第三层电子数目比第一层多1个,则B为Al元素,C-比A元素的离子多1个电子层,则C为Cl元素,D元素的原子核外第二层比第一层多2个电子,则D为C元素,据此答题.
| 0.4g |
| 0.01mol |
解答:
解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=
=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素,B元素原子核外第三层电子数目比第一层多1个,则B为Al元素,C-比A元素的离子多1个电子层,则C为Cl元素,D元素的原子核外第二层比第一层多2个电子,则D为C元素,
(1)根据元素周期律,同主族元素,从上向下,氢化物的稳定性逐渐减弱,所以氟化氢的稳定性比氯化氢强,由于氟化氢分子之间有氢键的存在,所以氟化氢的沸点高于氯化氢,
故答案为:强;高;
(2)二氧化碳的电子式为 ,因为甲烷是正四面体结构,所以它的二氯代物有1种结构,
,因为甲烷是正四面体结构,所以它的二氯代物有1种结构,
故答案为: ;1;
;1;
(3)用电子式表示氯化镁的形成过程为 ,
,
故答案为: ;
;
(4)Mg、Al与NaOH溶液构成原电池,Al为负极,正极为Mg,负极反应为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Mg;Al-3e-+4OH-=AlO2-+2H2O.
| 0.4g |
| 0.01mol |
(1)根据元素周期律,同主族元素,从上向下,氢化物的稳定性逐渐减弱,所以氟化氢的稳定性比氯化氢强,由于氟化氢分子之间有氢键的存在,所以氟化氢的沸点高于氯化氢,
故答案为:强;高;
(2)二氧化碳的电子式为
 ,因为甲烷是正四面体结构,所以它的二氯代物有1种结构,
,因为甲烷是正四面体结构,所以它的二氯代物有1种结构,故答案为:
 ;1;
;1;(3)用电子式表示氯化镁的形成过程为
 ,
,故答案为:
 ;
;(4)Mg、Al与NaOH溶液构成原电池,Al为负极,正极为Mg,负极反应为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Mg;Al-3e-+4OH-=AlO2-+2H2O.
点评:本题主要考查了元素周期律、电子式、原电池的电极反应式等知识,中等难度,元素推断是解题关键,答题是注意第(4)问,铝做负极是易错点.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
| A、用氯气和消石灰制漂白粉 |
| B、用氢气和氮气合成氨 |
| C、用铁矿石炼铁 |
| D、用石灰石生产生石灰 |
据《自然》杂志网站2013年1月3日报道,德国物理学家用钾原子首次造出一种低于绝对零度的量子气体.科学家称这一成果为“实验的绝技”,为将来造出负温度物质、新型量子设备打开了大门,有助于揭开宇宙中的许多奥密.钾的化合物在科技、生活生产中应用广泛,则下列叙述正确的是( )
| A、超氧化钾(KO2)可作为飞船、潜艇等密闭系统的氧气再生剂,若有1molKO2被消耗,可产生O2 22.4L |
| B、高锰酸钾溶液是实验室常用的试剂,欲配置1.00L 0.10mol/L的KMnO4溶液,可将15.8g KMnO4溶于1L水中 |
| C、KNO3可用于制造黑火药,已知黑火药反应为S+2KNO3+3C=K2S+N2↑+3CO2↑,若有1mol KNO3被消耗,则该反应转移电子5×6.02×1023 |
| D、氰化钾(KCN、剧毒)可用于电镀,使镀层更细致,65g KCN晶体中,离子总数为2×6.02×1023 |
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |
对下列氧化还原反应中转移电子数的判断,不正确的是( )
| A、H2S+H2SO4(浓)=S↓+SO2↑+2H2O:6e- |
| B、3Cl2+6KOH5KCl+KClO3+3H2O:5e- |
| C、2Na2O2+2H2O=4NaOH+O2↑:2e- |
| D、2H2S+SO2=3S+2H2O:4e- |
下列实验设计及其对应的离子反应方程式正确的是( )
A、用惰性电极电解MgCl2 溶液:2Cl-+2H2O
| ||||
| B、用浓盐酸酸化的高锰酸钾溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | ||||
| C、向NH4Al(SO4)2溶液中逐滴加入过量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3?H2O | ||||
| D、向澄清石灰水中滴加同浓度的少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |