题目内容
下列实验操作中,正确的是( )
| A、配制5%NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 |
| B、过滤时可用温度计代替玻璃棒 |
| C、分液时球形和梨形分液漏斗的活塞可以放在相同的位置 |
| D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
考点:配制一定物质的量浓度的溶液,过滤,分液和萃取
专题:化学实验基本操作
分析:A.配制氯化钠溶液需要计算需要质量,用天平称量,得到固体在水中溶解;
B.温度计是测定温度的仪器,水银球处易破损;
C.球形、梨形分液漏斗中的活塞和斜口长端相对位置不一样;
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出.
B.温度计是测定温度的仪器,水银球处易破损;
C.球形、梨形分液漏斗中的活塞和斜口长端相对位置不一样;
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出.
解答:
解:A.配制溶液时,称量固体放入烧杯中溶解,故A正确;
B.温度计不可代替玻璃棒搅拌,易造成损坏,故B错误;
C.球形、梨形分液漏斗中的活塞和斜口长端相对位置不一样,活塞位置不同,故C错误;
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出;避免分离的液体中混入杂质,故D错误;
故选A.
B.温度计不可代替玻璃棒搅拌,易造成损坏,故B错误;
C.球形、梨形分液漏斗中的活塞和斜口长端相对位置不一样,活塞位置不同,故C错误;
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出;避免分离的液体中混入杂质,故D错误;
故选A.
点评:本题考查了溶液配制的步骤,蒸发、分液过程的操作,仪器的使用,掌握实验基本操作是解题关键,题目较简单.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
一定条件下,发生反应:①M(s)+N(g)?R(g)△H=-Q1 kJ?mol-1,②2R (g)+N(g)?2T (g)△H=-Q2 kJ?mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
| A、1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | ||
| B、将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | ||
C、当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+
| ||
| D、M(g)+N(g)?R(g)△H=-Q3 kJ?mol-1,则Q3<Q1 |
下列有关表述正确的是( )
A、质量数为16的氧原子:
| ||||
| B、纯碱的化学式:NaHCO3 | ||||
C、Mg2+结构示意图: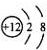 | ||||
D、铁丝在氯气中燃烧的化学方程式:Fe+Cl2
|
将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g,滤液质量比原石灰水减少5.8g,该有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
Zn与稀HNO3反应的物质的量之比为5:12,氧化产物为硝酸锌,则HNO3被还原的产物为( )
| A、NO |
| B、NO2 |
| C、N2 |
| D、N2O3 |
 “学生甲”通过中和滴定的方法,去测定在空气中露置一段时间后的NaOH固体的纯度,设计如下方案:
“学生甲”通过中和滴定的方法,去测定在空气中露置一段时间后的NaOH固体的纯度,设计如下方案: