题目内容
16.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
分析 A.常温常用下Vm大于22.4L/mol;
B.质量转化为物质的量,结合1个水分子含有3个原子解答;
C.质量转化为物质的量,结合1个氧原子含有8个电子;
D.氦气分子是单原子分子.
解答 解:A.常温常用下Vm大于22.4L/mol,11.2LO2所含的原子数为小于1.5NA,故A错误;
B.常温常压下,18gH2O物质的量为1mol,所含的原子数为3NA,故B错误;
C.标准状况下,16gO2所含的电子数为$\frac{16g}{16g/mol}$×8×NA=8NA,故C正确;
D.标况下,11.2L氢气和氦气的混合气体的物质的量是0.5mol,且氦气分子是单原子分子,所含的原子数为大于0.5NA个小于NA个,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数计算和应用,明确物质的构成和气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知某元素+2价阳离子的电子排布式为1s22s22p63s23p6,该元素在周期表中属于( )
| A. | ⅤB族 | B. | ⅡB族 | C. | Ⅷ族 | D. | ⅡA族 |
11.某酒精检测仪是以酸性燃料电池原理设计的,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法不正确的是( )
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
8.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是ad
a.热量关系:a+b=92.4
b.三个容器内反应的平衡常数:③>①=②
c.平衡时氨气的体积分数:①=②>③
d.①N2的转化率+②NH3的转化率=100%
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
a.热量关系:a+b=92.4
b.三个容器内反应的平衡常数:③>①=②
c.平衡时氨气的体积分数:①=②>③
d.①N2的转化率+②NH3的转化率=100%
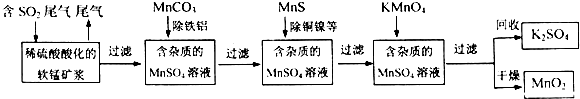

 .
.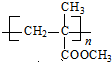 .
.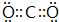 .
.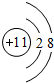 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式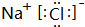 .
.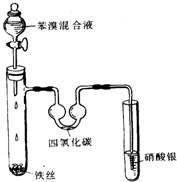 (1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现
(1)苯分子中的碳碳之间的化学键是一种独特的键,因此其化学性质一般表现