题目内容
5.有A、B、C、D、E五种元素,它们的核电荷数依次增大.已知:A失去一个电子后就成为一个质子;B有两个电子层,其最外层的电子数是次外层电子数的2倍;C的L层得2个电子后成为稳定结构;D是海水中含量第一位的金属元素;E的最外层电子比次外层电子少一个.请填写下列空格:
(1)A形成的单质的结构式为H-H; BC2的电子式
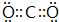 .
.(2)D离子的结构示意图
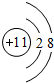 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式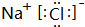 .
.(3)B、C、D三种元素可形成一种化合物,其化学式为Na2CO3,所含的化学键有离子键、共价键.
分析 有A、B、C、D、E五种元素,它们的核电荷数依次增大.A失去一个电子后就成为一个质子,则A为氢元素; B有两个电子层,其最外层的电子数是次外层电子数的2倍,最外层电子数为4,则B为碳元素;C的L层得2个电子后成为稳定结构,其L层电子数为8-2=6,则C为氧元素;D是海水中含量第一位的金属元素,则D为Na;E原子序数大于Na,最外层电子比次外层电子少一个,由于最外层电子数不能超过8,故E次外层电子数只能为8,最外层电子数=8-1=7,则E为Cl,据此解答.
解答 解:有A、B、C、D、E五种元素,它们的核电荷数依次增大.A失去一个电子后就成为一个质子,则A为氢元素; B有两个电子层,其最外层的电子数是次外层电子数的2倍,最外层电子数为4,则B为碳元素;C的L层得2个电子后成为稳定结构,其L层电子数为8-2=6,则C为氧元素;D是海水中含量第一位的金属元素,则D为Na;E原子序数大于Na,最外层电子比次外层电子少一个,由于最外层电子数不能超过8,故E次外层电子数只能为8,最外层电子数=8-1=7,则E为Cl.
(1)A形成的单质为H2,氢气分子中H原子之间形成1对共用电子对,其结构式为H-H,CO2分子中C原子与O原子之间形成2对共用电子对,其电子式为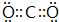 ,
,
故答案为:H-H;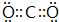 ;
;
(2)Na+离子核外有2个电子层,各层电子数为2、8,离子的结构示意图为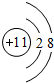 ,Na、Cl结合形成的化合物为NaCl,由钠离子与氯离子过程,其电子式为
,Na、Cl结合形成的化合物为NaCl,由钠离子与氯离子过程,其电子式为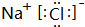 ,
,
故答案为: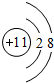 ;
;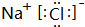 ;
;
(3)C、O、Na三种元素可形成一种化合物,其化学式为Na2CO3,含有离子键、共价键,
故答案为:Na2CO3;离子键、共价键.
点评 本题考查结构性质位置关系应用,难度不大,侧重对化学用语的考查,注意掌握电子式的书写.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
16.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
20. A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表
请根据表中的信息回答下列问题:
(1)D离子的结构示意图: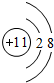 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: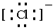 .
.
(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
(1)D离子的结构示意图:
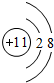 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: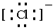 .
.(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
10.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
14.氰化物有剧毒,工业废水中氰化物(CN-)的最高允许排放浓度为0.5mg/L;对废水中CN-(N为-3价)的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化.发生的反应为:2CN-+8OH-+5Cl2═2CO2↑+N2↑+10Cl-+4H2O.下列有关说法正确的是( )
| A. | 上述反应中氧化产物只有N2 | |
| B. | 当有0.4molCO2生成时,反应中转移的电子的总数目约为1.204×1024 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.02mg/L的废水,至少需用4.0×10-5molCl2处理后才符合排放标准 |
15.下列说法正确的是( )
| A. | CaCl2是中性干燥剂可以干燥NH3、SO2 | |
| B. | 检查病人胃病所用的钡餐,既可以用BaSO4,也可以用BaCO3 | |
| C. | 氮氧化物的大量排放是造成光化学烟雾的主要原因 | |
| D. | 雨水样品放置一段时间后,酸性增强的原因是因为溶解了空气中的CO2 |
 化学与人们生活质量的提高以及社会发展有着密切的关系.
化学与人们生活质量的提高以及社会发展有着密切的关系.