题目内容
14.已知某元素+2价阳离子的电子排布式为1s22s22p63s23p6,该元素在周期表中属于( )| A. | ⅤB族 | B. | ⅡB族 | C. | Ⅷ族 | D. | ⅡA族 |
分析 某元素+2价阳离子的电子排布式为1s22s22p63s23p6,则该元素原子核外电子排布式为1s22s22p63s23p64s2,属于主族元素,主族族序数等于最外层电子数.
解答 解:某元素+2价阳离子的电子排布式为1s22s22p63s23p6,则该元素原子核外电子排布式为1s22s22p63s23p64s2,属于主族元素,最外层电子数为2,处于第四周期ⅡA族,故选:D.
点评 本题考查核外电子排布、结构与位置关系,比较基础,理解掌握根据核外电子排布确定元素位置.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.在无土栽培中,需配制20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若以KCl、NH4Cl和(NH4)2CO3三种固体为原料配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体的物质的量依次为(单位为mol)( )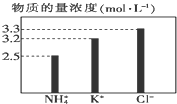

| A. | 2、64、24 | B. | 64、2、24 | C. | 64、24、2 | D. | 16、2、24 |
5.如图所示的实验操作中,正确的是( )
| A. |  检查容器瓶是否漏水 | B. |  给溶液加热 | ||
| C. |  滴加液体 | D. |  过滤 |
2.下列实验操作或事故处理正确的是( )
| A. | 分液时,打开分液漏斗旋转活塞,先放出下层液体,再放出上层液体 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 过滤时,为了加快速度,用玻璃棒搅拌悬浊液 |
9.下列实验方法错误的是( )
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
19.久置空气中不会因氧化还原反应而变质的物质是( )
| A. | 亚硫酸 | B. | 氯水 | C. | 氯化亚铁 | D. | 烧碱 |
6.下列化学用语书写正确的是( )
| A. | 乙烯的结构简式 CH2CH2 | |
| B. | 氯离子的结构示意图: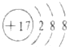 | |
| C. | H2O的电子式: | |
| D. | 碳酸钾的电离方程式 K2SO4=K2++SO42- |
16.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |