题目内容
8.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
a.热量关系:a+b=92.4
b.三个容器内反应的平衡常数:③>①=②
c.平衡时氨气的体积分数:①=②>③
d.①N2的转化率+②NH3的转化率=100%
分析 a.②按化学计量数转化到左边时得到1molN2(g)、3molH2(g),与①的起始状态相同,恒温恒容下,②与①为完全等效平衡,平衡时对应各组分的物质的量相等,假设平衡时氮气为nmol,计算反应热可得关系式;
b.平衡常数只与温度有关,故三种情况下平衡常数相等;
c.②与①为完全等效平衡,平衡时相同组分的含量相同,③与①相比,③到达的平衡相当于在①的平衡基础上压强增大1倍,平衡向右移动,NH3的物质的量增大、混合气体总的物质的量减小;
d.②与①为完全等效平衡,平衡时对应各组分的物质的量相等,假设平衡时氮气为nmol,计算转化率可得关系式.
解答 解:a.②按化学计量数转化到左边时得到1molN2(g)、3molH2(g),与①的起始状态相同,恒温恒容下,②与①为完全等效平衡,平衡时对应各组分的物质的量相等,假设平衡时氮气为nmol,则a=(1-n)×92.4,b=(2-2n)×$\frac{1}{2}$×92.4,故a+b=92.4,故a正确;
b.平衡常数是只与温度有关的物理量,与物质的浓度无关,温度相等平衡常数相等,即:①=②=③,故b错误;
c.②与①为完全等效平衡,故平衡时氨气体积分数相等,③与①相比,③到达的平衡相当于在①的平衡基础上压强增大1倍,平衡向右移动,NH3的物质的量增大、混合气体总的物质的量减小,平衡时NH3气体的体积分数增大,故c错误;
d.②与①为完全等效平衡,平衡时对应各组分的物质的量相等,假设平衡时氮气为nmol,则①N2的转化率=$\frac{(1-n)mol}{1mol}$=(1-n),②NH3的转化率=$\frac{nmol×2}{2mol}$=n,则二者转化率之和=1-n+n=100%,故d正确;
故答案为:ad.
点评 本题考查化学平衡计算,题目难度中等,可利用等效平衡思想解题,构建平衡建立的途径是解题的关键,注意a、d选项中规律的归纳总结,试题培养了学生的分析能力及化学计算能力.

| A. | 乙烯的结构简式 CH2CH2 | |
| B. | 氯离子的结构示意图: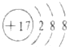 | |
| C. | H2O的电子式: | |
| D. | 碳酸钾的电离方程式 K2SO4=K2++SO42- |
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
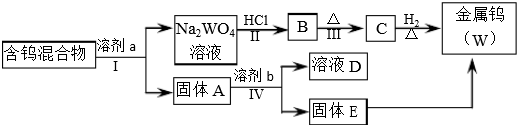
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
(1)D离子的结构示意图:
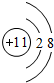 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: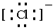 .
.(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
| A. | 酸性氧化物:CO2、SO2、SiO2、Na2O | B. | 盐:Na2CO3、KHCO3、Cu2(OH)2CO3 | ||
| C. | 非电解质:酒精、蔗糖、NH3、次氯酸 | D. | 混合物:液氯、盐酸、胆矾、氯水 |
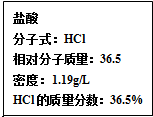 化学与人们生活质量的提高以及社会发展有着密切的关系.
化学与人们生活质量的提高以及社会发展有着密切的关系.