题目内容
1.实验室可以用高锰酸钾和浓盐酸反应制取氯气(Cl2),反应的化学方程式如下:2KMnO4+16HCl(浓)﹦2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥法标出电子转移情况.
2KMnO4+16HCl(浓)﹦2KCl+2MnCl2+5Cl2↑+8H2O
(2)浓盐酸在反应中体现出还原性和酸性.
(3)KMnO4的氧化性比Cl2的氧化性强(选填“强”或“弱”).
(4)当反应中转移了2mol电子时,有2mol HCl被氧化,产生Cl2在标准状况下体积为22.4L.
(5)某同学欲用KMnO4固体配制90mL 0.5mol/L的溶液.回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、.
②应用托盘天平称取KMnO4固体7.9g.
③不规范的实验操作会导致实验结果的误差,下列操作会导致所配溶液浓度偏低的是CD.
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.颠倒摇匀后发现凹液面低于刻度线又加水补上
D.在溶解过程中有少量液体溅出烧杯外.
分析 (1)反应中2molKMnO4得到10mol电子,HCl失去10mol电子,则单线桥法标出电子转移的方向和数目为: ;H(2)HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,生成氯化氯和氯化钾中的氯的化合价未变,体现是酸性;
;H(2)HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,生成氯化氯和氯化钾中的氯的化合价未变,体现是酸性;
(3)反应中高锰酸钾是氧化剂,而氯气是氧化产物,利用强制弱,分析解答;
(4)当反应中转移了1mol电子时,有 1mol HCl被氧化,Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 转移电子
5×22.4L 10
VL 2mol
由此分析解答;
(5)①根据各仪器的作用选取仪器;
②m(KMnO4)=CVM;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小.
解答 解:(1)反应中2molKMnO4得到10mol电子,HCl失去10mol电子,则单线桥法标出电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,生成氯化氯和氯化钾中的氯的化合价未变,体现是酸性,故答案为:还原性和酸性;
(3)反应中高锰酸钾是氧化剂,而氯气是氧化产物,利用强制弱,所以KMnO4的氧化性强于Cl2的氧化性,故答案为:强;
(4)当反应中转移了1mol电子时,有 1mol HCl被氧化,所以2mol的电子转移就有2mol的电子移转,Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 转移电子
5×22.4L 10
VL 2mol
V=$\frac{5×22.4×2}{10}$=22.4L,故答案为:2mol;22.4 L;
(5)①配制90mL溶液,需要配制100mL,则还需要100mL容量瓶、用于定容的胶头滴管,故答案为:100mL容量瓶;胶头滴管;
②m(KMnO4)=CVM=0.5mol/L×0.1L×158g/mol=7.9g,故答案为:7.9;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小,
A.加水定容时俯视刻度线,导致溶液体积偏小,配制溶液浓度偏大,故错误;
B.容量瓶内壁附有水珠而未干燥处理,溶液体积和溶质物质的量都不变,则配制溶液浓度不变,故错误;
C.颠倒摇匀后发现凹液面低于刻度线又加水补上,导致溶液体积偏大,配制溶液浓度偏小,故正确;
D.在溶解过程中有少量液体溅出烧杯外,溶质的物质的量偏小,配制溶液浓度偏小,故正确;
故答案为:CD.
点评 本题考查氧化还原反应、溶液的配制,把握反应中元素化合价变化以及误差分析的方法为解答的关键,侧重电子转移方向和数目、以及溶液配制操作的考查,题目难度不大.

| A. | 亚硫酸 | B. | 氯水 | C. | 氯化亚铁 | D. | 烧碱 |
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
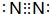 .
.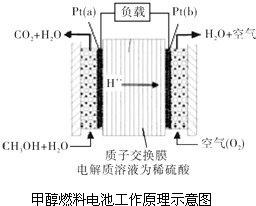 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示: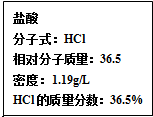 化学与人们生活质量的提高以及社会发展有着密切的关系.
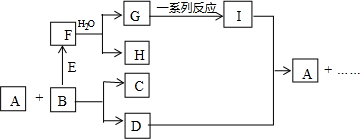
化学与人们生活质量的提高以及社会发展有着密切的关系.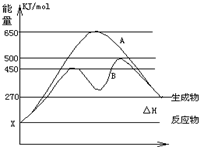 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答: