题目内容
10.某化学小组利用以下装置制备氨气、氯气以及LiH固体.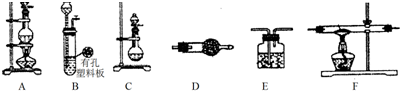
(1)为制备干燥的氨气,可将装置C与D(填装置编号)连接;装置C中的烧瓶内加入的固体宜选用a.(填选项字母)
a.生石灰 b.氯化钙 c.五氧化二磷
(2)连接装置A、E、E可制取纯净、干燥的氯气,则两个E装置内的药品依次是饱和食盐水、浓硫酸;装置A中发生反应的离子方程式为2Cl-+MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)该小组准备利用上述部分装置制备LiH固体.可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰.已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能引起燃烧.设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是检验装置的气密性(不必写出具体的操作方法);加入药品后,其中装置D的作用是除去H2中的H2O和HCl.
②通入一段时间氢气后加热石英管,在加热F处的石英管之前,必须进行的实验操作是收集F处排出的气体并检验H2纯度.
③加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处.采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险.完成LiH与水反应的化学方程式LiH+H2O=LiOH+H2↑.
④准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为6:1.
分析 (1)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,能够促进氨气的挥发,用碱石灰干燥氨气,选择装置D;
(2)依据制备氯气装置是利用二氧化锰和浓盐酸加热反应,生成氯化锰、氯气和水,生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;(3)氢气和锂发生反应生成LiH,制备LiH固体需要制备氢气,LiH在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用B装置制备氢气,用装置D中的碱石灰除去氢气中的氯化氢和水蒸气,通入装置F中加热和锂反应生成氢化锂,最后连接装置E,防止空气中的水蒸气和二氧化碳进入装置F和生成的氢化锂发生反应.
①制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性,装置D中应选择药品为碱石灰,除去H2中的H2O和HCl,防止干扰实验;
②使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险;
③氢化锂与足量的水反应生成氢气和氢氧化锂;
④设LiH与Li的物质的量分别为xmol、ymol,根据方程式表示出生成氢气的物质的量,再根据二者总质量、氢气总体积列方程计算解答.
解答 解:(1)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,浓氨水中存在平衡:NH4++OH-?NH3•H2O NH3+H2O,加热或者加热碱性物质能够促进平衡正向移动,有利于氨气的挥发,而生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,氢氧化钙、氢氧化钠溶于水电离产生氢氧根离子,促进平衡向正方向移动,有利于氨气的挥发,所以为制备干燥的氨气,可将装置C(分液漏斗中放浓氨水,圆底烧瓶中放生石灰)与D(用碱石灰干燥氨气)连接,制备干燥的氨气,
故答案为:D;a;
(2)二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,生成的氯气中含有氯化氢和水蒸气,由于氯气难溶于饱和食盐水,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,
故答案为:饱和食盐水、浓硫酸;2Cl-+MnO2+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)①制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;装置D中应选择药品为碱石灰,碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体,
故答案为:检验装置的气密性;除去H2中的H2O和HCl;
②使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险,在加热F处的石英管之前,必须进行的实验操作是:收集F处排出的气体并检验H2纯度,
故答案为:收集F处排出的气体并检验H2纯度;
③LiH与水反应生成LiOH、H2,反应方程式为:LiH+H2O=LiOH+H2↑,
故答案为:LiH+H2O=LiOH+H2↑;
④设LiH与Li的物质的量分别为xmol、ymol,则:
LiH+H2O=H2↑+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2↑
ymol 0.5y mol
则$\left\{\begin{array}{l}{8x+7y=0.11}\\{22.4(x+0.5y)=0.2912}\end{array}\right.$,
解得x=0.012、y=0.002
故LiH与Li的物质的量之比为0.012mol:0.002mol=6:1,
故答案为:6:1.
点评 本题考查气体的制备和性质实验,综合考查了氯气、氨气的制备和性质,涉及对装置及操作的分析评价、气体收集、化学方程式的计算等,理解原理是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C3H6 |
| A. | 室温下,测得0.1 mol/L 的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 向 NaAlO2溶液中通入过量CO2 制 Al(OH)3:CO2+AlO2-+2H20=HC03-+Al(OH)3↓ | |
| D. | 铅酸蓄电池在充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O |
| A. | 煤中存在苯、二甲苯,工业上可由煤蒸馏获得 | |
| B. | 直馏汽油和裂化汽油中分别加入溴的四氯化碳溶液均能发生化学反应 | |
| C. | 石油的裂化、裂解和煤的干馏、气化都属于化学变化 | |
| D. | 石油裂解是生产乙烯的主要方法,乙烯和聚乙烯均能使溴水发生反应而褪色 |
| A. | 混合气体的密度不再发生变化 | |
| B. | 反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2 | |
| C. | 每生成3molH2的同时消耗2molNH3 | |
| D. | 每断裂1molN≡N键的同时断裂6molN-H键 |

