题目内容
15.下列物质中:(填写序号)①液氯 ②正丁烷 ③白磷 ④氯气⑤异丁烷 ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷.
(1)互为同分异构体的有②和⑤ (2)互为同素异形体的有③和⑧
(3)属于同位素的有⑥和⑦ (4)属于同一种物质的有①和④.
分析 (1)分子式相同、结构不同的化合物,互为同分异构体;
(2)由相同元素组成的形态不同的单质,互为同素异形体;
(3)质子数相同、中子数不同的同一元素的不同核素,互为同位素;
(4)分子式相同、结构相同的物质是同一种元素.
解答 解:(1)②正丁烷和⑤异丁烷的分子式相同,结构不同,互为同分异构体,
故答案为:②和⑤;
(2)③白磷和⑧红磷都是由磷元素构成的不同单质,互为同素异形体,
故答案为:③和⑧;
(3)⑥${\;}_{17}^{37}$Cl和 ⑦${\;}_{17}^{35}$Cl都是氯元素的不同核素,互为同位素,
故答案为:⑥和⑦;
(4)①液氯和 ④氯气都是Cl2呈现不同的状态时的称谓,是同一种物质,
故答案为:①和④.
点评 本题考查本题考查化学基本概念,涉及同分异构体、同素异形体、同位素、同种物质,为高频考点,难度不大,注意相似概念的比较和辨析.

练习册系列答案
相关题目
13.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s);△H=-348.3kJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
3.用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
表中a、b的值分别为:a=50、b=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:加入最后一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
20.下列实验操作正确或能达到实验目的是( )
| A. | 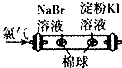 比较Cl2、Br2、I2的氧化性相对强弱 | B. | 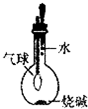 探究烧缄溶解时的热效应 | ||
| C. | 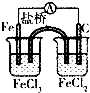 将化学能转化为电能 | D. |  配制一定物质的量浓度的溶液 |
4.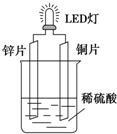 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)在卡片上,记录合理的是⑤⑥(填序号).
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯(在锌片表面形成原电池).
(3)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),
如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(4)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(5)有同学利用原电池原理,将A、B、C、D四种金属设计下表中装置进行实验用以判断四种金属的活泼性强弱.
根据以上现象,判断四种金属活泼性由强到弱的顺序是D>A>B>C.
 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:| 实验后的记录: ①Zn片发生还原反应,Cu片发生氧化反应 ②H+向负极移动 ③LED发光时,电子流动方向Zn→导线→Cu,再经溶液流回铜片 ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥装置中存在“化学能→电能→光能”的转换 |
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯(在锌片表面形成原电池).
(3)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),
如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(4)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(5)有同学利用原电池原理,将A、B、C、D四种金属设计下表中装置进行实验用以判断四种金属的活泼性强弱.
| 序号 | 甲 | 乙 | 丙 |
| 装置 | 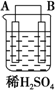 | 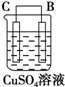 | 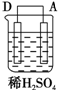 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
5.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.下列做法不符合绿色化学理念的是( )
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 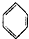 +CH2=CH2→ +CH2=CH2→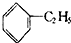 |
 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.