题目内容
6.在同温同压下,10ml某气态烃在50mLO2里充分燃烧,得到液态水和体积为35ml混合气体,该烃的分子式可能为( )| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C3H6 |
分析 令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,充分燃烧:CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O,再利用气体体积差量计算解答.
解答 解:令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,故烃完全燃烧,有氧气剩余,
CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l) 气体体积减小△V
1 1+$\frac{y}{4}$
10mL 60mL-35mL=25mL
10mL:25mL=1:(1+$\frac{y}{4}$)
解得y=6,
故选BD.
点评 本题考查有机物分子式确定、化学方程式计算,难度中等,较好的考查学生分析和解决问题的能力,注意运用气体体积差计算解答.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
16.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):
(1)其中原子半径最小的是H元素,没有正化合价的是O、F元素.
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
3.用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
表中a、b的值分别为:a=50、b=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:加入最后一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).
8.下列有机物的命名正确的是( )
| A. | 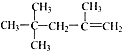 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |








 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.