题目内容
20.在一定条件下的密闭容器中,一定能说明可逆反应:N2(g)+3H2(g)?2NH3(g)达到平衡状态的是( )| A. | 混合气体的密度不再发生变化 | |
| B. | 反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2 | |
| C. | 每生成3molH2的同时消耗2molNH3 | |
| D. | 每断裂1molN≡N键的同时断裂6molN-H键 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、体积固定的容器中,混合气体的密度一直不再发生变化,故A错误;
B、任何情况下的反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2都成立,故B错误;
C、都体现的是逆向,未体现正与逆的关系,故C错误;
D、方向相反,化学键的断裂与化学计量数成正比例关系,故平衡,故D正确.
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有机物的命名正确的是( )
| A. | 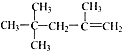 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
15.已知元素的原子序数,可以推知原子的①中子数 ②核电荷数 ③核外电子数 ④质量数⑤元素在周期表中的位置⑥元素的主要化合价,其中正确的是( )
| A. | ①③ | B. | ②③ | C. | ②③⑤⑥ | D. | ①②③④⑤⑥ |
5.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.下列做法不符合绿色化学理念的是( )
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 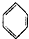 +CH2=CH2→ +CH2=CH2→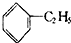 |
12.下列有关0.2 mol/L Fe(NO3)2溶液的叙述正确的是( )
| A. | 该溶液中Na+、K+、[Fe(CN)6]3-、I- 可以大量共存 | |
| B. | 滴加稀硫酸,充分振荡无现象 | |
| C. | 通入H2S气体,发生反应的离子方程式为Fe2++S2-═FeS↓ | |
| D. | 50 mL该溶液与过量Zn充分反应,生成0.56 g Fe |
9.氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述不正确的是( )
| A. | “两水”都能与FeCl2溶液反应 | |
| B. | “两水”中都存在可逆反应 | |
| C. | “两水”都有刺激性气味 | |
| D. | “两水”都是混合物,溶液中含有的粒子种类数相同 |
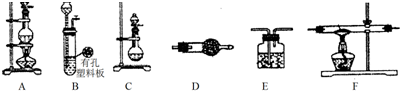
10.用下图所示实验装置进行相应实验,能达到实验目的是( )
| A. | 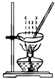 所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 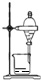 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 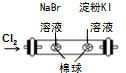 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 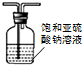 所示装置,除去SO2中混有的少量HCl气体 |