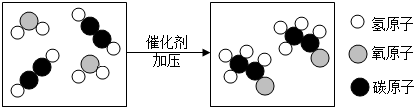
题目内容
9.碳是形成化合物种类最多的元素,其单质及化和物是人类生产生活的主要能源物质.请回答下列问题:(1)有机物M经过太阳光光照后可转化成N,转化过程如下:

M与N相比,M较稳定,则该反应的△H>(填“>”或“<”)0.
(2)已知CH3OH(l)的燃烧热△H=-238.6kJ•mol-1,CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-a kJ•mol-1,则a<(填“>”“<”或“=”)238.6.
(3)将CO2通过灼热的炭层生成的CO可作为城市管道煤气,若反应后气体质量增加2g时吸收28.75kJ的热量,写出该反应的热化学方程式:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
分析 (1)M与N相比,M较稳定,所以M转化为N是吸热反应;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)若反应后气体质量增加2g时也就是参加反应的碳是2g,吸收的热量,所以反应的热化学方程式为:CO2(g)+C(s)=2CO(g)△H=+$\frac{12}{2}×28.75$=+172.5Kj/mol.
解答 解:(1)M与N相比,M较稳定,所以M转化为N是吸热反应,△H>0;
故答案为:>;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,故答案为:<;
(3)若反应后气体质量增加2g时也就是参加反应的碳是2g,吸收的热量,所以反应的热化学方程式为:CO2(g)+C(s)=2CO(g)△H=+$\frac{12}{2}×28.75$=+172.5kJ/mol,故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,热化学方程式的书写等知识,掌握基础是解题关键,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
19.几种短周期元素的原子半径及主要化合价如表所示,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径(×10-10m) | 1.60 | 1.86 | 0.75 | 0.74 | 1.02 |
| 主要化合价 | +2 | +1 | +5,-3 | -2 | +6,-2 |
| A. | Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物中含离子键和极性键 | |
| B. | 最简单氢化物的稳定性:Z>M | |
| C. | 最简单氢化物的沸点高低顺序为:R>M | |
| D. | 最高价氧化物对应水化物的碱性强弱顺序为:X>Y |
4. 某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )
某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )
 某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )
某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )| A. | 该反应的氧化剂是CLO- | |
| B. | 该反应中有两种离子生成 | |
| C. | 该反应生成1mol氧化产物时,转移的电子为6mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为2:3 |