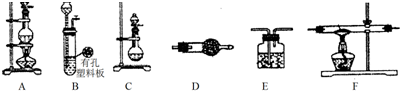
题目内容
8.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
分析 A、a和b不连接时,Fe与硫酸铜溶液发生置换反应;
B、a和b用导线连接时,形成原电池,铜离子在正极得电子;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;
D、a和b用导线连接时,形成原电池,铜为正极,发生还原反应.
解答 解:A、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,所以铁片上会有金属铜析出,故A正确;
B、a和b用导线连接时,形成了原电池,铜作正极,发生的反应为:Cu2++2e-=Cu,故B正确;
C、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论a和b是否连接,铁片均会溶解,溶液从硫酸铜的蓝色逐渐变成硫酸亚铁的浅绿色,故C正确;
D、a和b用导线连接时,形成原电池,铁为负极,铁失电子逐渐溶解,铜离子在正极铜上得电子,所以铜片上发生还原反应,故D错误.
故选D.
点评 本题考查学生化学反应与原电池反应,其本质都是氧化还原反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
19.几种短周期元素的原子半径及主要化合价如表所示,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径(×10-10m) | 1.60 | 1.86 | 0.75 | 0.74 | 1.02 |
| 主要化合价 | +2 | +1 | +5,-3 | -2 | +6,-2 |
| A. | Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物中含离子键和极性键 | |
| B. | 最简单氢化物的稳定性:Z>M | |
| C. | 最简单氢化物的沸点高低顺序为:R>M | |
| D. | 最高价氧化物对应水化物的碱性强弱顺序为:X>Y |
16.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):
(1)其中原子半径最小的是H元素,没有正化合价的是O、F元素.
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
3.下列分子中所有原子一定处于同一平面的是( )
| A. | CH2=CH-CH=CH2 | B. | CH2=CH-C≡CH | C. |  | D. |  |
13.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s);△H=-348.3kJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |
 ,C
,C .
.