题目内容
20.关于胶体和溶液的叙述正确的是( )| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| D. | 带电的胶体粒子在电场作用下可定向移动,溶液中的离子在电场作用下也可定向移动 |
分析 A、从胶体分散系呈电中性分析;
B、根据胶体聚沉的条件和复分解的条件分析;
C.胶体区别于其他分散系最本质的特征是胶体是分散质粒子直径的大小;
D.胶体具有电泳现象,电解质溶液通电溶液中离子定向移动在电极上发生氧化还原反应.
解答 解:A、溶液呈电中性,胶体分散系不带电,是胶体粒子吸附带电离子,故A错误;
B、胶体加入电解质溶液会发生聚沉可产生沉淀,复分解发生的条件之一是生成沉淀,所以溶液可以生成沉淀,溶液氢氧化钡与硫酸钠反应生成硫酸钡沉淀,故B错误;
C.胶体区别于其他分散系最本质的特征是胶体是分散质粒子直径10-9-10-7m之间,丁达尔效应是胶体的性质,故C错误;
D.胶体离子吸附带电离子,带电的胶体粒子在电场作用下可定向移动,溶液中的离子在电场作用下也可定向移动发生氧化还原反应,故D正确;
故选D.
点评 本题考查了胶体性质,胶体与其他分散系的本质区别,题目难度不大,熟悉胶体的性质及判断即可解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 在标准状况下,11.2 L H2O所含的分子数为0.5NA | |
| C. | 在常温常压下,1 mol O2含有的原子数为2NA | |
| D. | 只有在标准状况下的气体摩尔体积才是22.4L/mol. |
8.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂,氧化产物、还原产物都是N2 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
15.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 0.5mol 1,3一丁二烯分子中含有的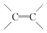 数为NA 数为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
5.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系是纯净物 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 通入了1molCl2的新制氯水中,HC1O、Cl一、C1O-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1 molCl2与足量Fe反应转移电子数为0.3NA | |
| B. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| C. | 常温常压下,4.2g环丙烷和聚乙烯的混合物中含有的碳原子数为0.3 NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
10.某化学小组用如图所示的装置制取氯气,下列说法不正确的是( )
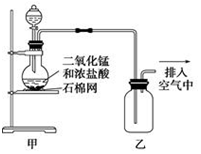

| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
 .
.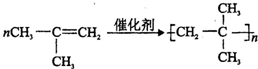 ;E→F
;E→F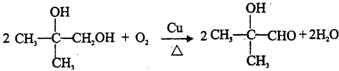 .
.