题目内容
15.设阿伏加德罗常数为NA,则下列说法正确的是( )| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 0.5mol 1,3一丁二烯分子中含有的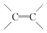 数为NA 数为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
分析 A.一个-CH3含有9个电子;
B.一个 1,3一丁二烯分子含有2个碳碳双键;
C.标准状况下,戊烷不是气体;
D.一个丙烷含有10个共价键.
解答 解:A.一个-CH3含有9个电子,15g甲基(-CH3)所含有的电子数是9NA,故A错误;
B.每个 1,3一丁二烯分子含有2个碳碳双键,0.5mol 1,3一丁二烯分子中含有的 数为NA,故B正确;
数为NA,故B正确;
C.标准状况下,戊烷不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算,故C错误;
D.一个丙烷含有10个共价键,因此1mol丙烷所含有的共价键数目为10NA,故D错误;
故选B.
点评 本题考查阿伏伽德罗常数的计算,为高频考点,侧重于物质组成和结构的考查,题目难度不大,注意公式n=$\frac{V}{{V}_{m}}$的使用条件.

练习册系列答案
相关题目
6.对于相同物质的量的SO2和SO3,下列说法中正确的是( )
| A. | 硫元素的质量比为5:4 | B. | 分子数之比为1:1 | ||
| C. | 原子总数之比为2:3 | D. | 质量之比为1:1 |
3.下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
| A. | C(s)+O2(g)═CO2(g)△H1; C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(s)△H2 | |
| C. | 2H2(s)+O2(g)═2H2O(g)△H1 H2(s)+$\frac{1}{2}$O2(g)═H2O(g)△H2 | |
| D. | CaO(s)+H2O(l)═Ca(OH)2(s)△H1; CaCO3(s)═CaO(s)+CO2(g)△H2 |
10.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式:CH2-CH2-CH2 | B. | 丙烷分子的比例模型: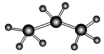 | ||
| C. | 四氯化碳分子的电子式: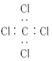 | D. | 1丁烯分子的键线式: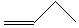 |
20.关于胶体和溶液的叙述正确的是( )
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| D. | 带电的胶体粒子在电场作用下可定向移动,溶液中的离子在电场作用下也可定向移动 |
7.某学生对Na2SO3与AgNO3在不同 pH 下的反应进行探究.
(1)测得Na2SO3溶液 pH=10、AgNO3 溶液 pH=5.
(2)调节 pH,实验记录如表:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3 溶液.
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应.
该学生对 a 中的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3
②白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取 b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4.实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将 c 中 X 滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 X 中滴加稀盐酸,无明显变化.
Ⅱ.向 X 中加入过量浓硝酸,产生红棕色气体.
Ⅲ.用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色
沉淀.
①实验Ⅰ的目的是检验棕黑色物质X是否为Ag2O.
②根据上述现象,分析 X 的成分是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析 X 产生的原因是:随着酸性的增强,体系的还原性强.
(1)测得Na2SO3溶液 pH=10、AgNO3 溶液 pH=5.
(2)调节 pH,实验记录如表:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3 溶液.
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应.
该学生对 a 中的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3
②白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取 b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4.实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将 c 中 X 滤出、洗净,为确认其组成,实验如下:
Ⅰ.向 X 中滴加稀盐酸,无明显变化.
Ⅱ.向 X 中加入过量浓硝酸,产生红棕色气体.
Ⅲ.用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色
沉淀.
①实验Ⅰ的目的是检验棕黑色物质X是否为Ag2O.
②根据上述现象,分析 X 的成分是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析 X 产生的原因是:随着酸性的增强,体系的还原性强.
4.下列实验事实解释正确的是( )
| A. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸 | |
| B. | 在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含SO42- | |
| D. | 将铝片放入浓硫酸中,无明显实验现象,说明铝在冷的浓硫酸中不反应 |