题目内容
2.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;
②Cm-、E(m-1)具有相同的电子层结构;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;
④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语
回答下列问题:
(1)HmDm的电子式为
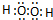 .
.(2)HmC与C元素的具有漂白性的氧化物反应的化学方程式为:2H2S+SO2=3S↓+2H2O,该反应中氧化产物与还原产物的质量之比为:2:1
(3)用电子式表示C的氢化物的形成过程
 ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.(4)在A、B、C、E形成的单质中,符合下列转化关系的是Na、S (填元素符号).
(5)由A、B、D三种元素形成的化合物与E元素的最高价含氧酸按物质的量之比2:7反应的离子方程式:6AlO2-+21H+=5Al3++Al(OH)3↓+9H2O.
分析 根据题意,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,则A、B为金属,A与B质子数之和是D质子数的3倍,则A、B的质子数之和为3的倍数,故A、B处于第三周期,则A为Na元素、B为Al元素;D的质子数为:$\frac{11+13}{3}$=8,则D为氧元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据;②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,以此解答该题.
解答 解:A、B、C、D、E是位于短周期的主族元素,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,则A、B为金属,A与B质子数之和是D质子数的3倍,则A、B的质子数之和为3的倍数,故A、B处于第三周期,则A为Na元素、B为Al元素;D的质子数为:$\frac{11+13}{3}$=8,则D为氧元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据;②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,
(1)HmDm为H2O2,双氧水为共价化合物,其电子式为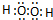 ,
,
故答案为: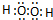 ;
;
(2)HmC为H2S,C元素的具有漂白性的氧化物为SO2,二者反应生成生成单质硫和水,反应方程式为:2H2S+SO2=3S↓+2H2O,该反应中硫化氢中-2价S元素被氧化生成S,二氧化硫中+4价S被还原生成S,则该反应中氧化产物与还原产物的质量之比为2:1,
故答案为:2H2S+SO2=3S↓+2H2O;2:1;
(3)C为S元素,其氢化物额硫化氢,硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为 ;
;
A是Na、C是S元素,则AmC是Na2S,用电子式表示硫化钠的形成过程为 ,
,
故答案为: ;
; ;
;
(4)A、B、C、E单质分别是Na、Al、S、Cl2,根据单质能连续被氧化可知,符合条件的是Na和S,
故答案为:Na、S;
(5)由A、B、D三种元素形成的化合物为NaAlO2,E元素的最高价含氧酸为HClO4,NaAlO2、HClO4按物质的量之比2:7反应,设物质的量分别为2mol、7mol,2mol偏铝酸钠消耗2mol高氯酸生成2mol氢氧化铝沉淀,剩余的5mol高氯酸能够溶解氢氧化铝的物质的量为:$\frac{5mol}{3}$=$\frac{5}{3}$mol,剩余氢氧化铝的物质的量为:2mol-$\frac{5}{3}$mol=$\frac{1}{3}$mol,所以反应生成铝离子和氢氧化铝的物质的量之比=$\frac{5}{3}$mol:$\frac{1}{3}$mol=5:1,该反应的离子方程式为:6AlO2-+21H+=5Al3++Al(OH)3↓+9H2O,
故答案为:6AlO2-+21H+=5Al3++Al(OH)3↓+9H2O.
点评 本题考查位置结构性质的关系及应用、常用化学用语、元素化合物性质等知识,题目难度中等,正确推断元素的种类为解答该题的关键,注意掌握原子结构与元素周期表、元素周期律的关系.

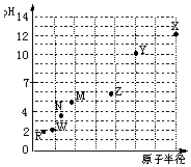 同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A. | 气态氢化物的稳定性:M>N | |
| B. | Z的最高价氧化物能溶于稀氨水 | |
| C. | X和W形成的常见化合物中阴、阳离子个数比为2:1 | |
| D. | Z和R的简单离子半径:Z3+<R- |
| A. | H2和D2互为同位素 | |
| B. | 12C原子是指质子数为6,中子数是12的一种核素 | |
| C. | 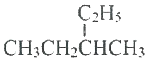 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| D. | 分子式为C2H6O、C4H10的有机物均有两种同分异构体 |
| 实验方案 | 预测实验现象 | 相应结论 | |
| A | 向酸性Fe(NO3)3溶液通入少量H2S | 有黄色沉淀 | Fe(NO3)3中铁元素具有氧化性 |
| B | CH3CH2Br与NaOH乙醇共热后将气体通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | CH3CH2Br与NaOH乙醇溶液共热生成乙烯 |
| C | 测定相同条件下等物质的量浓度的CH3COONa、NaHCO3的pH | NaHCO3溶液的pH大 | 酸性:碳酸<乙酸 |
| D | 10mL0.1mol/L的NaOH溶液滴入2mL等浓度的MgCl2溶液,然后再滴加FeCl3溶液 | 先出现白色沉淀,后沉淀变为红褐色 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
| A. | 随着原子序数的增大,元素的主要化合价逐渐增加 | |
| B. | 随着随着相对原子质量的增大,元素的化学性质会不断重复 | |
| C. | 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 | |
| D. | 卤素氢化物的稳定性随着核电荷数的增加而减弱 |
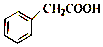 环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )
环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )| A. | 与苯甲酸互为同系物 | |
| B. | 有6种含酯基的芳香化合物与其互为同分异构体 | |
| C. | 能发生取代反应和加成反应 | |
| D. | 与CH3CH2OH所生成酯的分子式为C10H14O2 |
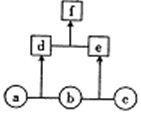 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )| A. | f受热易分解为d和e | |
| B. | 单质c具有强还原性 | |
| C. | 稳定性:d>e | |
| D. | 单质a中的元素在周期表中位于第二周期第ⅥA族 |
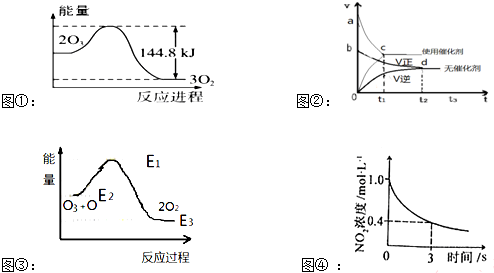
| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
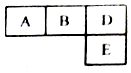 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |