题目内容
15.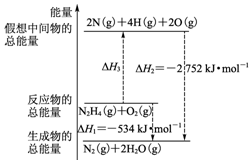 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
分析 A.根据N2、O2的键能分析,键能越大,分子越稳定;
B.图示的△H1=生成物的总能量-反应物的总能量,为N2H4、O2反应热;
C.根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可;
D.图中的△H3为N2H4(g)、O2(g)的活化能,需吸热,数数值等于△H1-△H2.
解答 解:A.化学键的断裂要吸收能量,N≡N键能942kJ,O=O键能500kJ,所以N≡N键能大,破坏需吸收更多的能量,相对于破坏氧气中O=O难,N2比O2稳定,故A正确;
B.根据图中内容,可以看出N2H4(g)+O2(g)?N2(g)+2H2O(g)△H1=-534 kJ•mol-1,故B正确;
C.根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol-534kJ/mol=2218kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molN-H键所需的能量为a,旧键断裂吸收的能量:154+4a+500=2218,解得a=391,故C错误;
D.根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=△H1-△H2=2752kJ/mol-534kJ/mol=+2218kJ/mol,故D正确;
故选C.
点评 本题考查学生化学键的断裂和生成与反应的吸放热之间的关系,考查学生知识的灵活应用情况,题目难度中等.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | H2和D2互为同位素 | |
| B. | 12C原子是指质子数为6,中子数是12的一种核素 | |
| C. | 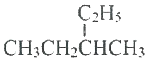 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| D. | 分子式为C2H6O、C4H10的有机物均有两种同分异构体 |
14.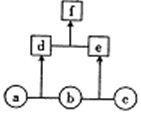 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )| A. | f受热易分解为d和e | |
| B. | 单质c具有强还原性 | |
| C. | 稳定性:d>e | |
| D. | 单质a中的元素在周期表中位于第二周期第ⅥA族 |
3.关于下列图象及其相关说法正确的是( )
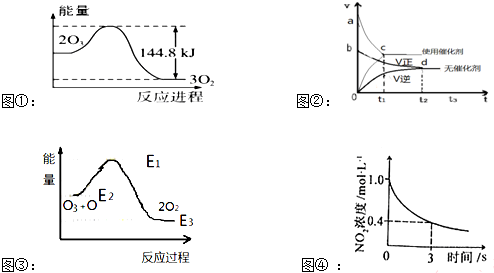

| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
20.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢,设计方案中一组数据如表:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,标况下,每生成89.6LCO2气体,转移4mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O.
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010mol•L-1•min-1.
| 编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010mol•L-1•min-1.
7.下列关于环境问题的说法正确的是( )
| A. | 回收废旧电池的首要原因是回收石墨 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 燃煤时加适量的生石灰可减少二氧化硫的排放 |
4.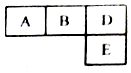 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |