题目内容
16.草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中.(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一.有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:CaC2O4(s)存在沉淀溶解平衡CaC2O4(s)?Ca2+(aq)+C2O42-(aq),EDTA结合Ca2+后,Ca2+浓度减小,导致上述平衡正向移动,结石溶解.
(2)已知:0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是abd(填字母序号).
a.0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
b.0.1mol•L-1 KHC2O4溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
c.浓度均为0.1mol•L-1 KHC2O4和K2C2O4的混合溶液中:2c(K+)=c(HC2O4-)+c(C2O42-)
d.0.1mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+).
分析 (1)根据EDTA结合Ca2+后对溶解平衡CaC2O4(s)?Ca2+ (aq)+C2O42-(aq)的影响分析;
(2)0.1mol•L-1KHC2O4溶液呈酸性,说明HC2O4-电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4);氢离子来自水的电离和HC2O4-电离,则c(H+)>c(C2O42-),据此结合物料守恒分析.
解答 解:(1)CaC2O4(s)存在沉淀溶解平衡:CaC2O4(s)?Ca2+ (aq)+C2O42-(aq),加入的EDTA试结合Ca2+,导致Ca2+浓度减小,该溶解平衡正向移动,结石溶解,
故答案为:CaC2O4(s)存在沉淀溶解平衡CaC2O4(s)?Ca2+ (aq)+C2O42-(aq),EDTA结合Ca2+后,Ca2+浓度减小,导致上述平衡正向移动,结石溶解;
(2)a.0.1mol•L-1KHC2O4溶液中,根据电荷守恒可知:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故a正确;
b.0.1mol•L-1 KHC2O4溶液中,溶液呈酸性,说明HC2O4-电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),则离子浓度大小为:c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故b正确;
c.浓度均为0.1mol•L-1 KHC2O4和K2C2O4的混合溶液中,根据物料守恒可得:2c(K+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4),故c错误;
d.0.1mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性,当钾离子与钠离子浓度相等时,反应生成草酸钠和草酸钾,溶液呈碱性,若为中性,则氢氧化钠应该少量,故c(K+)>c(Na+),故d正确;
故答案为:abd.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握难溶物溶解平衡及其影响,明确电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

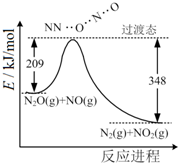
| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
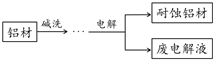 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
| A. | SO2 | B. | CO | C. | N2 | D. | NO2 |
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 硫酸 | D. | KNO3溶液 |
 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).