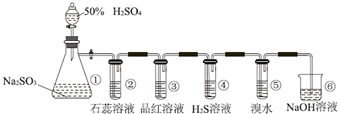
题目内容
11.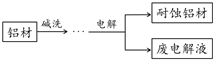 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
分析 A.氧化铝为两性氧化物,与强碱反应生成盐和水;
B.铝与强碱溶液反应生成偏铝酸盐和氢气;
C.阳极铝失去电子生成氧化铝和氢离子;
D.一水合氨与酸反应生成铵盐和水.
解答 解:A.氧化铝为两性氧化物,与强碱反应生成盐和水,反应的离子方程式:2OH-+Al2O3═2AlO2-+H2O,故A正确;
B.铝与强碱溶液反应生成偏铝酸盐和氢气,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B正确;
C.获得耐蚀铝材的电极反应为:2Al+3H2O-6e-=Al2O3+6H+,故C错误;
D.用稀氨水洗去耐蚀铝材表面的酸,离子方程式:NH3•H2O+H+═NH4++H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式方法是解题关键,注意铝及其化合物的性质,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液.
查阅资料得知:淀粉遇I2变蓝.
请帮助他们完成以下实验报告:
填空:
①验证Fe2+具有还原性③2Fe2++Cl2══2Fe3++2Cl- ⑤证明Fe2+具有氧化性⑧2Fe3++Fe══3Fe2+⑩证明Fe3+具有氧化性
综合以上实验,你能得到的结论是:⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可Fe2++2OH-=2Fe(OH)2↓.
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.保存亚铁盐溶液时如何防止亚铁盐被氧化加入少量铁粉.
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀.
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液.
查阅资料得知:淀粉遇I2变蓝.
请帮助他们完成以下实验报告:
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 | / | ⑤ | Zn+Fe2+═Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
| 实验4 | ⑨ | 在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 | 淀粉溶液变蓝 | ⑩ | 2Fe3++2I-═2Fe2++I2 |
①验证Fe2+具有还原性③2Fe2++Cl2══2Fe3++2Cl- ⑤证明Fe2+具有氧化性⑧2Fe3++Fe══3Fe2+⑩证明Fe3+具有氧化性
综合以上实验,你能得到的结论是:⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可Fe2++2OH-=2Fe(OH)2↓.
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.保存亚铁盐溶液时如何防止亚铁盐被氧化加入少量铁粉.
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀.
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
6.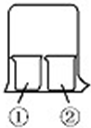 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
3.已知氯水中存在反应:Cl2+H2O?H++Cl-+HClO,取5mL饱和氯水进行如下实验.下列说法中,正确的是( )
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |
20.下列说法错误的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| C. | 对于有气体参加的反应,增大压强,反应速率加快 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
1.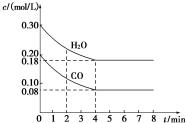 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
①表中3~4min时,反应v正=v逆(填“>”、“<”或“=”); C1>0.08mol/L(填“>”、“<”或“=”).
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C4 |
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.