题目内容
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
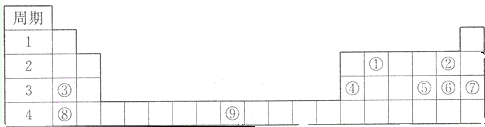
(1)属于过渡元素的是 (用相应的序号回答)
(2)非金属性最强的是 (用相应的元素符号回答)金属性最强的是 (用相应的元素符号回答)
(3)元素⑤形成的氧化物中,能使品红溶液褪色的是 (用化学式回答)
(4)元素③和元素⑤形成的化合物的电子式 .

(1)属于过渡元素的是
(2)非金属性最强的是
(3)元素⑤形成的氧化物中,能使品红溶液褪色的是
(4)元素③和元素⑤形成的化合物的电子式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置知①为C、②为F、③为Na、④为Al、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Fe.
(1)第3列~11列为过渡元素;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(3)元素⑤形成的氧化物中,二氧化硫具有漂白性,能使品红溶液褪色;
(4)元素③和元素⑤形成的化合物为Na2S,由钠离子与硫离子构成.
(1)第3列~11列为过渡元素;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(3)元素⑤形成的氧化物中,二氧化硫具有漂白性,能使品红溶液褪色;
(4)元素③和元素⑤形成的化合物为Na2S,由钠离子与硫离子构成.
解答:
解:由元素在周期表中位置知①为C、②为F、③为Na、④为Al、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Fe.
(1)第3列~11列为过渡元素,上述元素中⑨号元素Fe属于过渡元素,故答案为:⑨;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故元素上述元素中F的非金属性最强,K的金属性最强,故答案为:F;K;
(3)元素⑤形成的氧化物中,SO2具有漂白性,能使品红溶液褪色,故答案为:SO2;
(4)元素③和元素⑤形成的化合物为Na2S,由钠离子与硫离子构成,电子式为: ,故答案为:
,故答案为: .
.
(1)第3列~11列为过渡元素,上述元素中⑨号元素Fe属于过渡元素,故答案为:⑨;
(2)同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故元素上述元素中F的非金属性最强,K的金属性最强,故答案为:F;K;
(3)元素⑤形成的氧化物中,SO2具有漂白性,能使品红溶液褪色,故答案为:SO2;
(4)元素③和元素⑤形成的化合物为Na2S,由钠离子与硫离子构成,电子式为:
 ,故答案为:
,故答案为: .
.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期律的理解掌握,掌握电子式的书写.

练习册系列答案
相关题目
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从小到大的是( )
| A、p (Ne)<p (H2)<p (O2) |
| B、p (O2)<p (Ne)<p (H2) |
| C、p (H2)<p (O2)<p (Ne) |
| D、p (H2)<p (Ne)<p (O2) |
关于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H的有关图象如下:则下列不正确的是( )
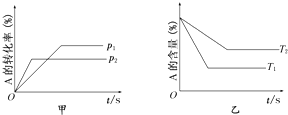

| A、p1<p2 T1>T2 |
| B、减小压强,正逆反应速率都减小,平衡右移 |
| C、△H>0△S>0 |
| D、升高温度,混合气体的平均摩尔质量增大 |
CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体.当产生0.5mol CO2时,转移的电子数目是( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
绚丽的焰火将上海世博会开幕式推向了高潮.焰火与高中化学中“焰色反应”知识有关.下列有关“焰色反应”说法中正确的是( )
| A、焰色反应为化学变化 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.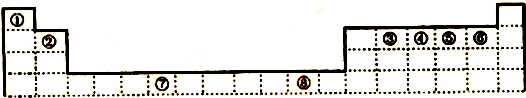
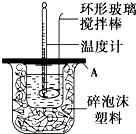 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
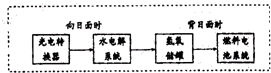
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题: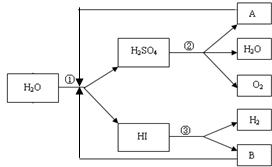 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程: