题目内容
13.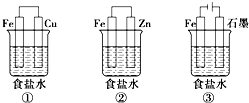 铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
分析 ①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护,称为牺牲阳极的阴极保护法;③装置为电解池,铁做阴极被保护,根据电极的腐蚀速率关系来判断.
解答 解:①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快,正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②中负极上金属锌失电子,电极反应为:Zn-2e-=Zn2+,金属铁被保护,此时金属铁可以采牺牲阳极的阴极保护法,装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,
故答案为:①;O2+2H2O+4e-=4OH-;②;Zn-2e-=Zn2+;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
点评 本题考查了金属腐蚀与防护的方法和应用、原电池和电解池的工作原理应用知识,注意原电池电极反应书写方法是基础,题目难度中等.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
4.下列离子方程式不正确的是( )
| A. | 碳酸铵溶液中通入足量二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| B. | 氯化铵溶液中加入稀氢氧化钠溶液:NH4++OH-?NH3•H2O | |
| C. | 氯化铵固体和熟石灰共热:NH4++OH-═NH3↑+H2O | |
| D. | 硫酸铵溶液与氢氧化钡溶液共热:2NH4++SO42-+Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ BaSO4↓+2NH3↑+2H2O |
8.科学家通过探寻矿物X推测外星球上是否曾经存在水.某兴趣小组为分析矿物X中的常见离子,将其溶于稀硝酸,并将所得溶液进行实验,下列依据实验现象得出的结论正确的是( )
| A. | 用铂丝蘸取少量溶液进行焰色反应,火焰呈紫色,说明矿物X中含K+ | |
| B. | 取少量溶液向其中滴加NaOH溶液,加热,用湿润红色石蕊试纸检验生成的气体,试纸变蓝,说明矿物X中含NH4+ | |
| C. | 取少量溶液向其中滴加KSCN溶液,溶液变为血红色,说明矿物X中含Fe3+ | |
| D. | 取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,说明矿物X中含SO42- |
3.下列实验中不需要使用温度计的是( )
| A. | 溴乙烷的水解 | B. | 苯的硝化反应 | C. | 石油的分馏 | D. | 由乙醇制乙烯 |

 .
. .
.
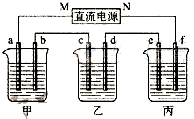 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.