��Ŀ����
7��ʵ������������������ҩƷ����ȡ������������������ȡCuCl2��ͼ�е�A��B��C��D��E��F��ʾ�����ܽӿڣ��ӿڵ��������쳤����δ������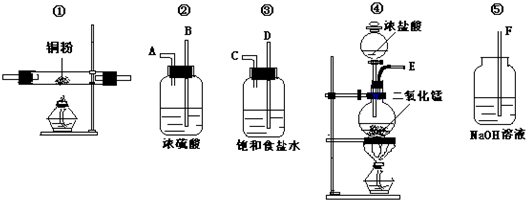
��1��������������������������������װ����ȷ����˳���ǣ�����ţ��ܢۢڢ٢ݣ� ���Т����װ������ʱ�������ܿ�Ӧ��C�ӣ�B����ĸ��
��2��װ�âݷ�����Ӧ�����ӷ���ʽCl2+2OH-�TCl-+ClO-+H2O��
��3��װ�âܷ����Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O���˷�Ӧ�У��������ͻ�ԭ�������ʵ���֮��Ϊ1��2��ÿ���ɱ�״����11.2L���壬ת�Ƶ��ӵ����ʵ���Ϊ1mol��
87g��������������Ũ���ᷴӦ���������������뺬4mol HCl��Ũ���ᷴӦ���ĸ����ɵ������ࣿǰ�� ���ǰ�ߡ����ߡ�����ԭ���淴Ӧ���У�����Ũ�Ƚ��ͣ���Ӧ���ٽ��У���
���� ��1�����������ӷ��������Ʊ���Ӧ�Ȼ������ʣ���ʹ������ͭ��Ӧ�����β������������������ӻ��߸���ʱ������˳��һ���ǣ��������̳�����ԭ��������ʵ��ԭ������Ũ������������̷��������������Ӻ���ͭ��Ӧ�����Ȼ�ͭ��β���������������գ��ݴ˴��⣻
��2������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��3������������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����Ӧ������4mol�Ȼ��⣬������2mol�Ȼ�����-1���Ȼ��ϼ����߱���������ԭ����ÿ����1mol����ת��2mol���ӣ���������ֻ����Ũ���ᷴӦ����ϡ�����Ӧ��
��� �⣺��1�����������ӷ��������Ʊ���Ӧ�Ȼ������ʣ���ʹ������ͭ��Ӧ�����β������������������ӻ��߸���ʱ������˳��һ���ǣ��������̳�����ԭ��������ʵ��ԭ������Ũ������������̷��������������Ӻ���ͭ��Ӧ�����Ȼ�ͭ��β���������������գ�������������˳��Ϊ���ܢۢڢ٢ݣ�
�����װ�������������ܽӿڣ���װ������ĸ��ʾ��Ӧ��C��B��
�ʴ�Ϊ���ܢۢڢ٢ݣ�C��B��
��2������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ�����ӷ���ʽ��Cl2+2OH-�TCl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-�TCl-+ClO-+H2O��
��3������������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����Ӧ����ʽ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����Ӧ������4mol�Ȼ��⣬������2mol�Ȼ�����-1���Ȼ��ϼ����߱���������ԭ�������������ʵ���Ϊ1mol�����������ͻ�ԭ�������ʵ���֮��Ϊ1��2��ÿ����1mol����ת��2mol���ӣ���ÿ���ɱ�״����11.2L���壬���ʵ���Ϊ$\frac{11.2L}{22.4L/mol}$=0.5mol��ת��1mol���ӣ�
87g��������������Ũ���ᷴӦ���������������뺬4mol HCl��Ũ���ᷴӦ���������������ȫ��Ӧ������������ʵ���һ���࣬���ǵ����ᶨ��ʱ�����ŷ�Ӧ���У�����Ũ�Ƚ��ͣ���Ϊϡ���ᣬ���ٷ�Ӧ������ǰ�����ɵ��������ں��ߣ�
�ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��1��2��1mol��ǰ�ߣ��淴Ӧ���У�����Ũ�Ƚ��ͣ���Ӧ���ٽ��У�
���� ���⿼���˳����������ȡ���ռ������ʼ��飬��ȷ�Ʊ�ԭ���������Ļ�ѧ�����ǽ���ؼ���ע��ֻ��Ũ������������̷�Ӧ����Ŀ�ѶȲ���

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�| A�� | ��ϩ���ӵ�˫������һ���������� | |
| B�� | ��ϩ����������ԭ�Ӷ���ͬһƽ���ϣ���̼���֮��ļ���Ϊ120�� | |
| C�� | ��ϩ�Ļ�ѧ���ʱ�������� | |
| D�� | ��ϩ�ͻ����飨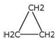 ���ķ�����ɷ���ͨʽCnH2n�������������ͬϵ�� ���ķ�����ɷ���ͨʽCnH2n�������������ͬϵ�� |
| A�� | Aԭ�ӵ�������������Bԭ�ӵ������������� | |
| B�� | ����ʱ��A�ܴ��������û�����������B���ܷ�Ӧ | |
| C�� | B���ܴ���Һ���û���A | |
| D�� | 1 mol Aʧȥ�ĵ��ӱ�1 mol Bʧȥ�ĵ��Ӷ� |
| A�� | K��ԭ�ӽṹʾ��ͼ 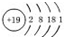 | B�� | CO2�Ľṹʽ O-C-O | ||
| C�� | C-12ԭ�ӵı�ʾ������C612 | D�� | NH4Cl�ĵ���ʽ��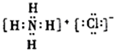 |

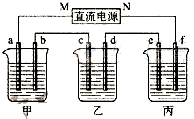 ��ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��200g��10.00%��NaCl��Һ��������CuSO4��Һ��200g��10.00%��KNO3��Һ���缫��Ϊʯī�缫��
��ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��200g��10.00%��NaCl��Һ��������CuSO4��Һ��200g��10.00%��KNO3��Һ���缫��Ϊʯī�缫��
