题目内容
9.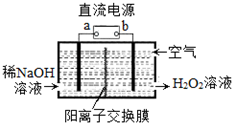 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
分析 由题给信息可知,通入氧气在阴极还原得到H2O2,元素化合价降低,则b为负极,a为正极;与a相连的一极为阳极,与b极相连的一极为阴极,阳离子向阴极移动,根据两电极得失电子数相等进行计算.
解答 解:由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,
A、通入氧气在阴极还原得到H2O2,元素化合价降低,则a为正极,故A错误;
B、通入空气的电极发生还原反应,电极反应式为O2+2e-+2H2O=H2O2+2OH-,故B错误;
C、左侧氢氧根离子放电,生成水和氧气,氢氧根离子浓度降低,故左侧溶液pH降低,故C正确;
D、根据电极反应O2+2e-+2H2O=H2O2+2OH-,若生成17g双氧水,转移1mol电子,有1molNa+从左侧向右侧迁移,故D错误;
故选C.
点评 本题考查电解原理、得电子的一极发生还原反应,失去电子的一极发生氧化反应,根据元素化合价的变化情况进行判断正负极、阴阳极,根据得失电子守恒进行相关计算,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
20.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难以氧化,而环上的支链不论长短,在强烈氧化时,最终能氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.
反应原理:
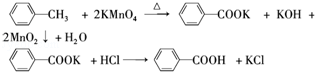
反应试剂、产物的物理常数:
主要实验装置和流程如下:
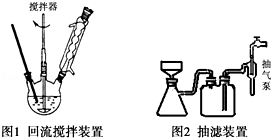
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
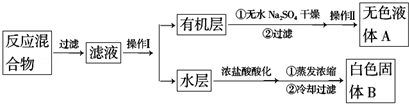
(1)操作Ⅰ所需的玻璃仪器为分液漏斗、烧杯;操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
反应原理:

反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)操作Ⅰ所需的玻璃仪器为分液漏斗、烧杯;操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
17.A、B、C、D均为短周期元素,且原子半径依次增大,其中A与B同周期且相邻,D和E同主族,A与E元素原子的电子层数相差2,A2-与D3+具有相同的电子层结构,A的最外层电子数是次外层的3倍,C的单质是一种半导体材料.下列说法正确的是( )
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
4.下列有关说法正确的是( )
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
1.为确定某溶液由以下离子Na+、Mg2+、Ba2+、SO42-、I-、CO32-中的哪几种微粒组成.进行以下实验,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | Mg2+ |
18.常温下,下列物质与水混合后静置,出现分层的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙酸 | D. | 氯化氢 |
13.25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa).在此温度下向20mL0.1mol•L-1H2R溶液中滴加0.1mol•L-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示.
下列有关说法正确的是( )
下列有关说法正确的是( )

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
