题目内容
4.下列有关说法正确的是( )| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
分析 A.纯水中水电离的氢离子、氢氧根离子的浓度相等;
B.由于粗铜中含有铁、锌等杂质,则两极质量不会不一定相等;
C.温度越低,化学反应速率越小;
D.稀释过程中醋酸、氢离子的浓度逐渐减小,水的离子积不变,则氢氧根离子的浓度逐渐增大.
解答 解:A.某温度下,pH=8的纯水中含含有的氢离子浓度为:c(H+)=10-8mol/L,该纯水中的氢离子、氢氧根离子浓度相等,都是10-8mol/L,故A错误;
B.由于粗铜中含有较活泼的铁、锌等杂质,电解时Fe、Zn优先放电,则电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值不一定相等,故B错误;
C.合成氨的反应是放热反应,则采用低温条件可以通过氨气的产率,但是氨的生成速率会减小,故C错误;
D.CH3COOH溶液加水稀释后,溶液中醋酸、氢离子的浓度逐渐减小,由于水的离子积不变,则此时过程中氢氧根离子的浓度逐渐增大,所以$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值会逐渐减小,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响及粗铜冶炼,题目难度中等,明确影响电离平衡的因素为解答关键,注意掌握粗铜的冶炼冶炼,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14. 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
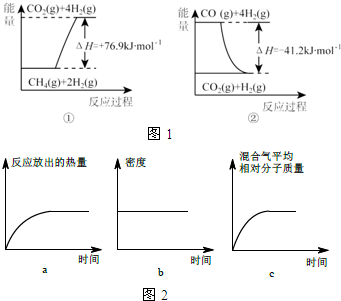
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气合成氨的反应正向为放热反应并且是体系压强减小的反应,升高温度平衡逆向移动;增大压强,平衡正向移动.
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).
15.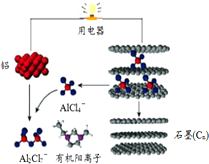 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
9.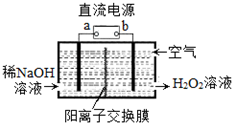 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
16.化学与人们的生活关系密切,下列说法不正确的是( )
| A. | 氯气可用于自来水的杀菌消毒 | B. | 氧化铁可用于红色油漆和涂料 | ||
| C. | 油脂可用于在碱性溶液制取肥皂 | D. | 含氮、磷的污水可用于给土壤施肥 |
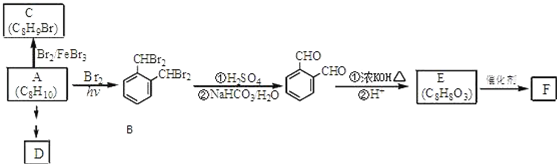
 ;
;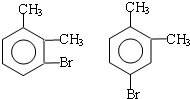 ;
;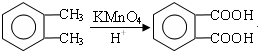 ;
; .(提示
.(提示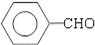 $\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$
$\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$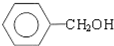 +
+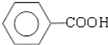 )
)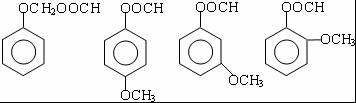 .
. .
.