题目内容
13.25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa).在此温度下向20mL0.1mol•L-1H2R溶液中滴加0.1mol•L-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示.下列有关说法正确的是( )

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
分析 A.a点溶液体积是原来的1.5倍,则含有R元素的微粒浓度是原来的$\frac{2}{3}$,根据物料守恒判断;
B.b点二者恰好完全反应生成NaHR,溶液呈酸性,说明HR-的电离程度大于水解程度,但其水解和电离程度都较小;
C.c点溶液溶质为等物质的量的Na2R、NaHR,如果Na2R、NaHR不水解且NaHR也不电离,则存在c(Na+)=3c(R2-),实际上R2-水解且HR-的电离程度大于水解程度;
D.d点溶液中溶质为Na2R,R2-水解但程度较小.
解答 解:A.a点溶液体积是原来的1.5倍,则含有R元素的微粒浓度是原来的$\frac{2}{3}$,根据物料守恒得c(H2R)+c(HR-)+c(R2-)=$\frac{1}{15}$mol•L-1,故A错误;
B.b点二者恰好完全反应生成NaHR,溶液呈酸性,说明HR-的电离程度大于水解程度,但其水解和电离程度都较小,钠离子不水解,所以离子微粒浓度大小顺序是c(Na+)>c(HR-)>c(R2-)>c(H2R),故B错误;
C.c点溶液溶质为等物质的量的Na2R、NaHR,如果Na2R、NaHR不水解且NaHR也不电离,则存在c(Na+)=3c(R2-),实际上R2-水解且HR-的电离程度大于水解程度,钠离子不水解,所以存在c(Na+)>3c(R2-),故C错误;
D.d点溶液中溶质为Na2R,R2-水解但程度较小,所以存在c(Na+)>c(R2-)>c(HR-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生图象分析及知识综合运用能力,明确曲线上对应点溶液中溶质成分及其性质是解本题关键,熟悉常见盐及其水解特点,题目难度中等.

练习册系列答案
相关题目
9.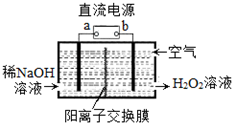 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
10.生石灰常用于治理酸性废水,下列说法合理的是( )
| A. | 生石灰主要成分是碱性化合物 | B. | 该过程只发生了物理变化 | ||
| C. | 生石灰主要成分是酸性化合物 | D. | 该过程同时实现了水软化 |
5.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A. | Z的氢化物的沸点是同主族元素中最高的 | |
| B. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有2种 | |
| C. | 仅由X、Y两种元素组成的化合物不止一种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
3.谚语“雷雨发庄稼”不包括下列哪个化学反应( )
| A. | N2+O2═2NO | B. | N2+3H2═2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | 3NO2+H2O═2HNO3+NO↑ |

 .
.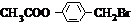 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+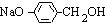 +NaBr+H2O,K与少量的氢氧化钠溶液反应:
+NaBr+H2O,K与少量的氢氧化钠溶液反应: +NaOH→
+NaOH→ +H2O.
+H2O.