题目内容
20.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难以氧化,而环上的支链不论长短,在强烈氧化时,最终能氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
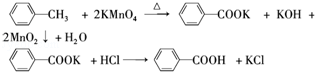
反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
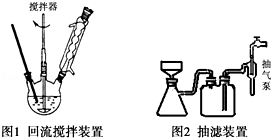
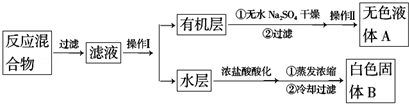
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
(1)操作Ⅰ所需的玻璃仪器为分液漏斗、烧杯;操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
分析 一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
(1)将滤液分离得到有机层和水层,可以用分液的方法;有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离;
(2)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,除去未反应的高锰酸钾;
(3)A.抽滤时,瓶中压强较小,可以加快过滤速度;
B.为了防止搅拌棒下端打坏三颈烧瓶底或温度计,因此不能与它们接触;
C.抽滤结束后,应注意先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头;
D.冷凝管中水的流向与蒸汽的流向相反,冷却效果好;
(4)除去残留在苯甲酸中的甲苯应先加入,应该先加NaOH溶液,甲苯与NaOH不反应,苯甲酸与NaOH反应生成苯甲酸钠,然后分液;
(5)发生C6H5COOH+KOH→C6H5COOK+H2O,结合反应计算.
解答 解:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机层和水层,有机层中含有甲苯、水层中含有苯甲酸,有机层中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水层盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸,
(1)将滤液分离得到有机层和水层,可以用分液的方法,所需的玻璃仪器为分液漏斗、烧杯;有机层中物质互溶且沸点不同,所以可以采用蒸馏方法分离,则操作II为蒸馏
故答案为:分液漏斗、烧杯;蒸馏;
(2)如果滤液呈紫色,说明高锰酸钾过量,要先加亚硫酸氢钾,除去未反应的高锰酸钾,否则浓盐酸酸化时可能被高锰酸钾氧化成氯气,
故答案为:除去未反应的高锰酸钾,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气;
(3)A.抽滤时,瓶中压强较小,可以加快过滤速度,得到较干燥的沉淀,故A正确;
B.为了防止搅拌棒下端打坏三颈烧瓶底或温度计,因此不能与它们接触,所以在搅拌时,搅拌棒下端不能与三颈烧瓶底、温度计等接触,故B正确;
C.抽滤结束后,应注意先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头,以防倒吸,故C错误;
D.冷凝管中水的流向与蒸汽的流向相反,则冷凝管中水的流向是下进上出,故D正确;
故答案为:ABD;
(4)除去残留在苯甲酸中的甲苯应先加入,应该先加NaOH溶液,甲苯与NaOH不反应,苯甲酸与NaOH反应生成苯甲酸钠,分液,苯甲酸钠溶液中加盐酸可以制得苯甲酸,
故答案为:NaOH溶液;浓盐酸酸化;
(5)设苯甲酸的物质的量浓度为x,则25mL苯甲酸溶液中苯甲酸的物质的量为0.025xmol,
C6H5COOH+KOH→C6H5COOK+H2O
1 1
0.025xmol 2.40×10-3mol
1mol:1mol=0.025xmol:2.40×10-3mol
x=$\frac{2.40×1{0}^{-3}×1}{1×0.025}$=0.96mol/L,
则100mL苯甲酸中苯甲酸的质量=0.096mol/L×0.1L×122g/mol=1.1712g,其质量分数为$\frac{1.1712g}{1.220g}$×100%=96%,
故答案为:96%.
点评 本题考查物质的制备实验,为高频考点,把握实验流程、制备原理、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,题目难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 1molKClO3所具有的总能量高于1molKCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1gKClO3,1gMnO2,0.1g Mn2O7混合加热,充分反应后MnO2质量为1g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
| A. | 热稳定性:H2Se>H2S | B. | 原子半径:Se>O | ||
| C. | 酸性:H2SO4>H2SeO4 | D. | 还原性:Se2->Cl- |
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾}{→}$溶液颜色无变化$\stackrel{滴加氯水}{→}$溶液变红色→溶液中含有Fe2+ | |
| C. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量硝酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
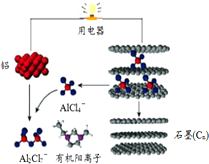 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了表格.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+═Fe3++NO2↑+H2O |
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到.
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
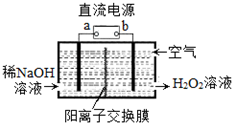 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
| A. | 生石灰主要成分是碱性化合物 | B. | 该过程只发生了物理变化 | ||
| C. | 生石灰主要成分是酸性化合物 | D. | 该过程同时实现了水软化 |
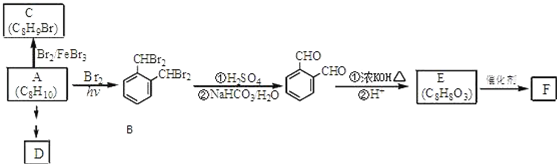
 ;
;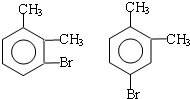 ;
;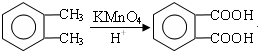 ;
; .(提示
.(提示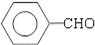 $\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$
$\underset{\stackrel{①浓KOH、△}{→}}{②{H}^{+}}$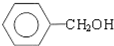 +
+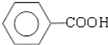 )
)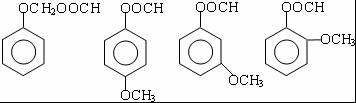 .
.