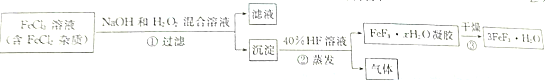
题目内容
3.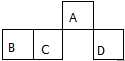 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rD>rC>rB>rA | |
| B. | 含D元素的盐溶液一定显中性 | |
| C. | 氢化物的热稳定性:C>D | |
| D. | D的单质能与A形成的氢化物反应生成具有漂白性的物质 |
分析 由短周期元素在周期表中的位置可知,A处于第二周期,B、C、D处于第三周期,A原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则A为O,可推知B为Si,C为P,D为Cl.
A.同周期随原子序数增大原子半径减小,一般电子层越多原子半径越大;
B.NaCl溶液呈中性,NaClO溶液呈碱性;
C.非金属性越强,对应氢化物越稳定;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性.
解答 解:由短周期元素在周期表中的位置可知,A处于第二周期,B、C、D处于第三周期,A原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则A为O,可推知B为Si,C为P,D为Cl.
A.同周期随原子序数增大原子半径减小,一般电子层越多原子半径越大,则原子半径为rB>rC>rD>rA,故A错误;
B.D为Cl,NaCl溶液呈中性,NaClO溶液呈碱性,故B错误;
C.非金属性D(Cl)>C(P),则最简单气态氢化物的热稳定性为D>C,故C错误;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,A为推断的突破口,熟练掌握元素周期律与元素化合物性质,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
11.下列说法正确的是( )
| A. | Na+、Fe2+、Cl-、NO3-等离子能在甲基橙试液显红色的溶液中共存 | |
| B. | K+、Mg2+、Cl-、I-等离子能在[H+]=10-12 mol•L-1的溶液中共存 | |
| C. | NaHS水解的离子方程式为:HS-+H2O?S2-+H3O+ | |
| D. | NaHCO3的电离方程式为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
7.A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素.
(1)BF2的结构式为S=C=S.
(2)D和F的氢化物中沸点较高的是H2O(填化学式).
(3)实验室制取G2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为C2H8N2+2N2O4=2CO2+3N2+4H2O.
(7)上述元素可组成盐Q:CA4E(FD4)2.向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| B | ||
| F |
(2)D和F的氢化物中沸点较高的是H2O(填化学式).
(3)实验室制取G2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为C2H8N2+2N2O4=2CO2+3N2+4H2O.
(7)上述元素可组成盐Q:CA4E(FD4)2.向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
4.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 在25℃时,反应可表示为X+3Y═2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 升高温度此反应的平衡常数增大 |
5.关于胶体的叙述中,不正确的是( )
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |

 ;
;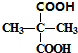 +2C2H5OH$?_{△}^{浓硫酸}$
+2C2H5OH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O. 、
、 .
.