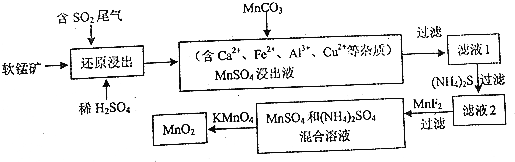
题目内容
13.下列各项中的离子方程式,书写正确的是( )| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
分析 A.多元弱酸,分步电离,以第一步为主;
B.NaHCO3为强电解质,完全电离;
C.NH3•H2O为弱碱,存在电离平衡;
D.过量的CO2气体通入饱和石灰水中,反应生成碳酸氢钙.
解答 解:A.多元弱酸,分步电离,以第一步为主,则电离方程式为H2S?H++HS-,故A错误;
B.NaHCO3为强电解质,完全电离,则电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.NH3•H2O为弱碱,存在电离平衡,则电离方程式为NH3•H2O?NH4++OH-,故C错误;
D.过量的CO2气体通入饱和石灰水中,反应生成碳酸氢钙,离子反应为CO2+OH-═HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电离、复分解反应的离子反应考查,注重学生分析与应用能力、思维严密性训练,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
5.某有机物A用质谱仪测定示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )


| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
4. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
(1)关于催化剂在实验过程中的催化作用,下列叙述正确的是AB(填序号)
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
1.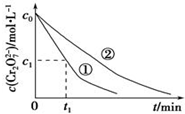 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
18.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |
5.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.下列说法不正确的是( )
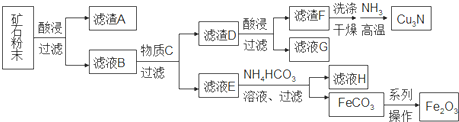

| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
2.已知同周期非金属元素X、Y的非金属性:X>Y,下列说法错误的是( )
| A. | X的原子序数一定大于Y | B. | 第一电离能Y可能大于X | ||
| C. | 简单离子的半径:Xm->Yn- | D. | 气态氢化物的稳定性:HmX强于HnY |
3.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |