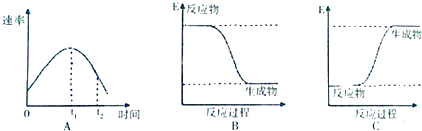
题目内容
8.某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,钙,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)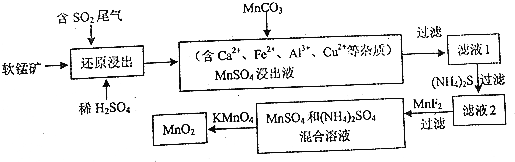
请回答下列问题:
(1)上述还原浸出是脱硫过程,实现了ad(选填编号).
a.废气物的综合利用 b.臭氧层空洞的减少 c.白色污染的减少 d.酸雨的减少
(2)写出上述软锰矿经还原浸出生成MnSO4的化学方程式是SO2+MnO2=MnSO4.
(3)用MnCO3能除去还原浸出液中的Al3+,请用离子方程式解释其原因是3MnCO3+2Al3++3H2O=3Mn2++3CO2↑+2Al(OH)3↓.
(4)加入(NH4)2S的目的主要是除去Cu2+;加入MnF2的目的主要是除去Ca2+;(填离子符号)
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是bc.(填编号)
aNaOH溶液、石蕊试液 b稀H2SO4酸化的KMnO4溶液 c碘水、淀粉溶液 d氨水、石蕊试液
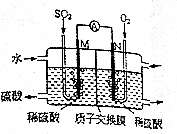
(6)用电化学法模拟工业处理SO2.将硫酸工业尾气中的SO2通入如图装置(电均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
①M极发生的电极反应式为SO2+2H2O-2e -═SO42-+4H+.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(保留3位小数,已知:1个e-所带电量为1.6×10-19
C).
分析 软锰矿(主要成分为MnO2,另含少量铁,钙,铜等金属化合物),二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,加入(NH4)2S将除去铜离子,再加氟化锰除去钙离子,得到硫酸铵和硫酸锰溶液,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)上述脱硫过程,可以实现废气物的综合利用和酸雨的减少;
(2)二氧化硫还原二氧化锰生成MnSO4根据元素守恒书写化学方程式;
(3)MnCO3能促进Al3+水解,生成氢氧化铝和二氧化碳,据此书写离子方程式;
(4)铜离子能与硫离子生成 硫化铜沉淀,钙离子能与氟离子生成 氟化钙沉淀;
(5)准确测定一定体积燃煤尾气中SO2含量可以用稀H2SO4酸化的KMnO4溶液滴定,也可以用碘水、淀粉溶液滴定,而石蕊试液不能作滴定的指示剂;
(6)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成;
②根据电流计算电量,再计算转移电子物质的量,根据电子转移守恒计算通入二氧化硫物质的量,进而计算体积.
解答 解:软锰矿(主要成分为MnO2,另含少量铁,钙,铜等金属化合物),二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,加入(NH4)2S将除去铜离子,再加氟化锰除去钙离子,得到硫酸铵和硫酸锰溶液,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)上述脱硫过程,可以实现废气物的综合利用和酸雨的减少,而与臭氧层空洞的减少、白色污染的减少无关,故选ad;
(2)二氧化硫还原二氧化锰生成MnSO4,反应的化学方程式为SO2+MnO2=MnSO4,故答案为:SO2+MnO2=MnSO4;
(3)MnCO3能促进Al3+水解,生成氢氧化铝和二氧化碳,而除去溶液中的铝离子,反应的离子方程式为3MnCO3+2Al3++3H2O=3Mn2++3CO2↑+2Al(OH)3↓,
故答案为:3MnCO3+2Al3++3H2O=3Mn2++3CO2↑+2Al(OH)3↓;
(4)铜离子能与硫离子生成 硫化铜沉淀,钙离子能与氟离子生成 氟化钙沉淀,所以加入(NH4)2S的目的主要是除去Cu2+,加入MnF2的目的主要是除去Ca2+,
故答案为:Cu2+;Ca2+;
(5)准确测定一定体积燃煤尾气中SO2含量可以用稀H2SO4酸化的KMnO4溶液滴定,也可以用碘水、淀粉溶液滴定,而石蕊试液不能作滴定的指示剂,故选bc;
(6)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,
故答案为:SO2+2H2O-2e -═SO42-+4H+;
②转移电子物质的量为(2A×60s÷1.6×10-19C)÷6.02×1023mol-1,则需要氧气体积为:[(2A×60s÷1.6×10-19C)÷6.02×1023mol-1]÷2×22.4L/mol≈0.014L,
故答案为:0.014.
点评 本题考查物质性质探究实验、原电池原理及计算等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.

 口算能手系列答案
口算能手系列答案| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 11g分子式为C3H8的链烃中含有的C-H的数目为2NA | |
| C. | 室温时,1.0L pH=13的 Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移的电子数为2NA |
| A. | 升温、水溶液中盐类水解平衡、弱酸的电离平衡、沉淀溶解平衡不一定朝正向移动 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,标明乙醇已被铜氧化为乙醛 | |
| C. | 我国古化文献《本草经集注》记载区分硝石(KNO3)与朴硝(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,是应用了焰色反应知识 | |
| D. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 |
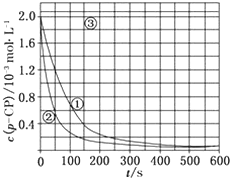 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |