题目内容
4. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
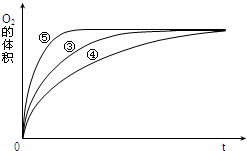
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析 (1)A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关.
(2)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答 解:(1)A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,故B正确;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故答案为:AB;
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)由图可知,⑤的反应速率最大,④的反应速率最小,③的反应速率居中,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查影响化学反应速率的因素,题目难度中等,试题侧重考查学生实验设计、数据处理、图象分析的综合能力,注意信息的利用即可解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列递变情况不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
17.下列说法中正确的是( )

| A. | 6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 | |
| B. | 常温下铁、铜均不溶于浓硫酸,说明常温下铁、铜与浓硫酸均不反应 | |
| C. | 离子化合物中只含离子键 | |
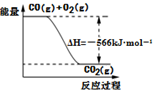
| D. | 已知:2CO(g)+O2(g)═2CO2(g);△H=-566 kJ•mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
14.下列有关实验的操作正确的是( )
| A. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| B. | 测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 测定碳酸钠中碳酸氢钠的含量:取a克样品与足量稀盐酸充分反应,逸出的气体通过碱石灰后,碱石灰增重b克,根据a和b的值即可求得碳酸氢钠的含量 |
1.下列说法不正确的是( )
| A. | 升温、水溶液中盐类水解平衡、弱酸的电离平衡、沉淀溶解平衡不一定朝正向移动 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,标明乙醇已被铜氧化为乙醛 | |
| C. | 我国古化文献《本草经集注》记载区分硝石(KNO3)与朴硝(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,是应用了焰色反应知识 | |
| D. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 |
9.某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液
称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
根据上述各数据,计算待测烧碱溶液的浓度为0.4020mol•L-1,烧碱(40g/mol)的纯度为98.05%.
(4)下列操作,会导致实验结果偏低的是①②⑥(填序号);若把待测烧碱溶液放在滴定管中,则会导致实验结果偏低的是①④.
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式 管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来.
(1)配制待测液
称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液,需要的主要仪器有:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
(4)下列操作,会导致实验结果偏低的是①②⑥(填序号);若把待测烧碱溶液放在滴定管中,则会导致实验结果偏低的是①④.
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式 管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来.
16. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
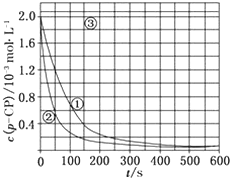
[数据处理]实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
13.下列各项中的离子方程式,书写正确的是( )
| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
14.已知某种微生物燃料电池工作原理如图所示.下列有关该电池的说法中,正确的是( )
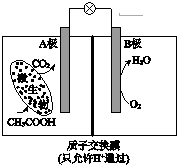

| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |