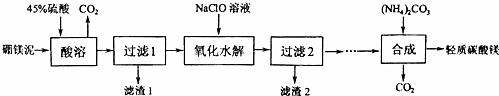
题目内容
5.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.下列说法不正确的是( )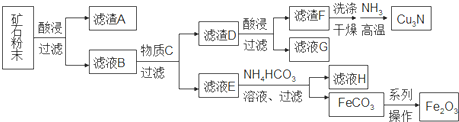
| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
分析 某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2,与酸反应,SiO2不反应,过滤滤渣A为是SiO2,滤液B中含有Cu2+、Fe2+、Fe3+,加C过滤,滤渣D最终转化为Cu3N,滤液最终转化为氧化铁,所以滤液E中含有Fe2+,滤渣D为Cu和多余的Fe,C为铁粉,滤渣D加酸溶解,过滤,滤液G为Fe2+溶液,滤渣F为Cu;滤液E中含有Fe2+与碳酸氢铵反应生成FeCO3,FeCO3在空气中煅烧得到Fe2O3,据此分析.
解答 解:某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2,与酸反应,SiO2不反应,过滤滤渣A为是SiO2,滤液B中含有Cu2+、Fe2+、Fe3+,加C过滤,滤渣D最终转化为Cu3N,滤液最终转化为氧化铁,所以滤液E中含有Fe2+,滤渣D为Cu和多余的Fe,C为铁粉,滤渣D加酸溶解,过滤,滤液G为Fe2+溶液,滤渣F为Cu;滤液E中含有Fe2+与碳酸氢铵反应生成FeCO3,FeCO3在空气中煅烧得到Fe2O3,
A.Cu转化为Cu3N,Cu的化合价升高1价,是还原剂,氨气做氧化剂,故A正确;
B.液E中含有Fe2+,加入NH4HCO3溶液,会发生双水解,在生成白色沉淀碳酸亚铁的同时会放出没有气味的气体二氧化碳,故B错误;
C.由分析可知,滤液G为Fe2+溶液,滤液E中含有Fe2+,所以滤液G可以并入滤液E加以利用,故C正确;
D.通过过滤把FeCO3从溶液中分离出来,需要洗涤、干燥,然后在空气中煅烧就得到Fe2O3,故D正确.
故选B.
点评 本题考查了物质的分离提纯方法和制备过程分析判断,题目难度中等,注意把握物质的分离提纯和制备流程以及物质的性质,掌握实验基本操作和物质性质是关键,侧重于考查学生的分析能力和对基础知识的应用能力.

 阅读快车系列答案
阅读快车系列答案
| A. | 6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 | |
| B. | 常温下铁、铜均不溶于浓硫酸,说明常温下铁、铜与浓硫酸均不反应 | |
| C. | 离子化合物中只含离子键 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g);△H=-566 kJ•mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
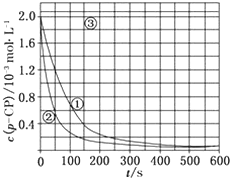 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表( 表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
| A. | H2S?2H++S2- | |
| B. | NaHCO3电离:NaHCO3?Na++HCO3- | |
| C. | 一水合氨电离:NH3•H2O═NH4++OH- | |
| D. | 过量的CO2气体通入饱和石灰水中:CO2+OH-═HCO3- |
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |
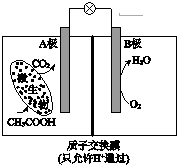
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |