题目内容
12. 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | Kl溶液 | D. | 饱和食盐水 |
分析 将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色,说明甲装置能吸收水或能和氯气反应.
解答 解:A、将潮湿的氯气通过浓硫酸时,浓硫酸有吸水性,导致氯气中不含水分,再通过放有干燥红色布条的乙装置,红色布条不褪色,故A不选;
B、氯气和氢氧化钠反应,将潮湿的氯气通过NaOH溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,故B不选;
C、氯气和碘化钾反应,将潮湿的氯气通过KI溶液后,再通过放有干燥红色布条的乙装置,红色布条不褪色,故C不选;
D、饱和NaCl溶液与氯气不反应,抑制氯气的溶解,但通过饱和食盐水时导致氯气中含有水分,所以红色布条会褪色,故D选;
故选D.
点评 本题考查氯气的化学性质,明确装置中甲瓶的作用是解答本题的关键,注意干燥的氯气不具有漂白性,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
8.物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
3.一定温度下,在2L的密闭容器中,冲入1molHI气体,能说明反应2HI(g)?H2(g)+I2(g)达到平衡状态的标志是( )
| A. | 单位时间内消耗1molH2,同时生成2molHI | |
| B. | 每断裂AmolH-I,同时有$\frac{A}{2}$molH-H断裂 | |
| C. | 容器中压强不再变化 | |
| D. | 容器中混合气体的密度不再变化 |
20.为确定某种抗酸药-碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]的组成,进行如下实验:
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
7.产物主要是Fe2O3的反应是( )
| A. | 铁在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | Fe2(CO4)3与氨水混合 | D. | 灼烧氢氧化铁固体 |
17.化学与人类生成、生活、社会可持续发展密切相关.下列说法不正确的是( )
| A. | 将“地沟油”反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 | |
| B. | 红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | 科学家推测月尘[即月球上直径小于10微米(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘在空气中形成的分散系不属于胶体 | |
| D. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
2.下列反应属于氧化还原反应的是( )
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | CaCO3=CaO+CO2↑ | D. | Mg+2HCl=MgCl2+H2↑ |
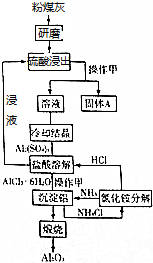 我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
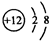 ;O的电子式为
;O的电子式为 ;H2S的结构式为H-S-H.
;H2S的结构式为H-S-H.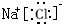 ,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.