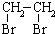题目内容
18. 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 为增强污水的导电能力,可向污水中加入适量乙醇 | |
| D. | 甲烷燃料电池中CO32-向空气一极移动 |
分析 左装置为电解池,右装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,石墨为阴极,阴极的电极反应为:2H++2e-=H2↑,以此解答该题.
解答 解:A.石墨为阴极,阴极的电极反应为:2H++2e-=H2↑,所以石墨上发生还原反应,故A错误;
B.电池是以熔融碳酸盐为电解质,通甲烷电极为负极,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,反应生成CO2,正极反应为O2+2CO2+4e-=2CO32-,反应消耗CO2,所以物质A为CO2,故B正确;
C.加入的乙醇是非电解质,不能增强导电性,故C错误;
D.电池中阴离子向负极移动,则电池中CO32-向甲烷一极移动,故D错误.
故选B.
点评 本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,难度中等.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
8.已知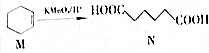 .下列说法错误的是( )
.下列说法错误的是( )
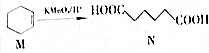 .下列说法错误的是( )
.下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | M中所有碳原子在同一平面上 | |
| C. | N能发生氧化反应和取代反应 | |
| D. | N的含有相同官能团的同分异构体有8种(不考虑立体异构) |
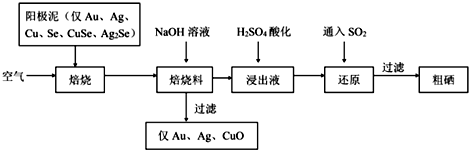
6. Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
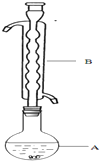
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起的误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
10.向一定量的Cu、Fe2O3的混合物中加入300mL0.5mol/L的H2SO4溶液,恰好使混合物完全溶解,所得溶液中加入KSCN 溶液后无红色出现.则原混合物中Cu 和Fe2O3物质的量之比为( )
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
7.为证明某可溶性一元酸(HX)是弱酸.有如下实验方案,其中不合理的是( )
| A. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| B. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 | |
| C. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| D. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
8.物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
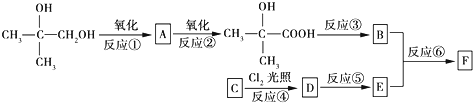
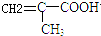 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$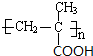 .
.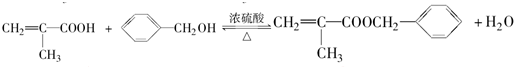 .
.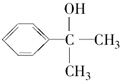 .
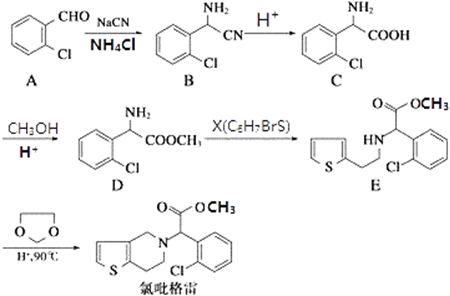
.

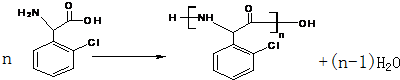 .(不需要写反应条件)
.(不需要写反应条件) ②
②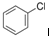 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(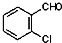 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、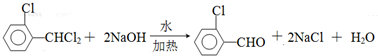 .
.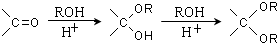
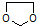 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2