题目内容
在100mL 0.01mol?L-1KCl溶液中,加入1mL 0.01mol?L-1AgNO3溶液,下列说法正确的是(已知AgCl Ksp=1.8×10-10)( )
| A、有沉淀但不是AgCl |
| B、无AgCl沉淀 |
| C、有AgCl沉淀析出 |
| D、无法确定 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:氯化银的溶解平衡为:AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),求算出氯离子、银离子的物质的量,混合后体积为0.101L,再计算出c(Ag+)、c(Cl-),代入氯化银的溶度积判断即可.
解答:
解:由AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(Cl-),混合后溶液体积是0.101L,n(Cl-)=0.1L×0.01mol?L-1=0.001mol,n(Ag+)=0.001L×0.01mol?L-1=0.00001mol=1×10-5mol?L-1,c(Ag+)=
=1×10-4mol/L,
则Ksp=c(Ag+)c(Cl-)=0.01mol/L×1×10-4mol/L=1×10-6mol2?L-2>1.8×10-10mol2?L-2,故有AgCl沉淀析出;
故选C.
| 1×10-5mol |
| 0.1L+0.001L |
则Ksp=c(Ag+)c(Cl-)=0.01mol/L×1×10-4mol/L=1×10-6mol2?L-2>1.8×10-10mol2?L-2,故有AgCl沉淀析出;
故选C.
点评:本题考查了根据难溶电解质溶度积判断沉淀情况,注意混合后溶液的体积的变化,题目难度一般.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铵明矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
 某原电池的结构如图所示,下列有关该原电池的说法中不正确的是( )
某原电池的结构如图所示,下列有关该原电池的说法中不正确的是( )| A、铁棒为正极 |
| B、铜棒发生还原反应 |
| C、电流从铜棒经外电路流向铁棒 |
| D、铁棒质量减轻 |
下列环境问题与化工生产没有直接关系的是( )
| A、雾霾 | B、酸雨 |
| C、土地沙漠化 | D、温室效应 |
图示原电池工作时,叙述正确的是( )
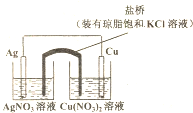

| A、在外电路中,电子由银电极流向铜电极 |
| B、正极反应为:Ag++e-=Ag |
| C、实验过程中取出盐桥,原电池仍能继续工作 |
| D、盐桥中的K+移向Cu(NO3)2溶液 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液.请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液.请回答下列问题: