��Ŀ����
8�����Ʊ��������о���ѧ�仯������Ҫ˼�뷽��������ϸ�۲����50mLϡ�����1g̼��Ʒ�Ӧ��ʵ�����ݣ�| ʵ�� ��� | ̼��� ״̬ | C��HCl��/mol•l-1 | ��Һ�¶�/�� | ̼�����ʧ ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||
| 1 | ��״ | 0.5 | 20 | 39 | 400 |
| 2 | ��ĩ | 0.5 | 20 | 40 | 60 |
| 3 | ��״ | 0.6 | 20 | 41 | 280 |
| 4 | ��ĩ | 0.8 | 20 | 40 | 30 |
| 5 | ��״ | 1.0 | 20 | 40 | 120 |
| 6 | ��״ | 1.0 | 30 | 50 | 40 |
��2��ʵ��5��6�����¶� �Է�Ӧ���ʵ�Ӱ�죮
��3���ӱ�ʵ�������з�����Ӱ�컯ѧ��Ӧ���ʵ����ػ��з�Ӧ��Ӵ�������ܱ�����һ���ɵ�ʵ�������1��2��
���� ��1��ͨ���������ݣ��Աȷ�Ӧǰ���¶ȱ仯��֪�÷�ӦΪ���ȷ�Ӧ��
��2����ʵ��5��6ʵ�����ݿ�֪������������ͬʱ���¶�Խ�ߣ�̼�����ʧ������ʱ��Խ�٣�
��3��ʵ��1��2�����ݷ�Ӧ�¶���ͬ�������Ũ����ͬ�����������״��ͬ������ʵ��������Ӱ�����أ�
��� �⣺��1��ͨ���������ݣ��Աȷ�Ӧǰ���¶ȱ仯��֪����Ӧ����Һ�¶����ߣ���ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��2����ʵ��5��6ʵ�����ݿ�֪������������ͬʱ���¶�Խ�ߣ�̼�����ʧ������ʱ��Խ�٣�˵���¶�Խ�ߣ���Ӧ����Խ��
�ʴ�Ϊ���¶ȣ�
��3��ʵ��1��2�����ݷ�Ӧ�¶���ͬ�������Ũ����ͬ�����������״��ͬ��ʵ�����ݱ�����ĩʱ�ķ�Ӧ���ʴ�����״�����˵���Ӵ����Խ��Ӧ����Խ��
�ʴ�Ϊ����Ӧ��ĽӴ������1��2��
���� ���⿼����������Է�Ӧ����Ӱ���ʵ��̽������Ŀ�ѶȲ���ͨ���Աȿɵó���ͬ��������Ի�ѧ��Ӧ���ʵ�Ӱ�죬ע��������ͼ�����ݵķ���������

��ϰ��ϵ�д�
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
�����Ŀ
17�����ά�ѳ�Ϊ��Ϣ���ز����ٵĸ������ϣ�����������ά�������ǣ�������
| A�� | �������� | B�� | ����� | C�� | ������ | D�� | ʯī |
18�����������У�����������ʵ��ǣ�������
| A�� | ����� | B�� | ����� | C�� | ������ | D�� | ������̼ |
13����5mL NaCl��Һ�е���һ��AgNO3��Һ�����ְ�ɫ�����������μ�һ��KI��Һ����������Ϊ��ɫ���ٵ���һ��Na2S��Һ���������ֱ�ɺ�ɫ�����������仯���̣����������ֳ�������ܶȻ���ϵΪ��������
| A�� | AgCl=AgI=Ag2S | B�� | AgCl��AgI��Ag2S | C�� | AgI��AgCl��Ag2S | D�� | AgCl��AgI��Ag2S |
20��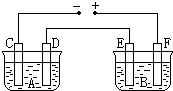 ��ͼ��ʾ��A����ʯī�缫�������������Һ��B�ؾ�����ͭ��һ��ʱ���ֹͣͨ�磬A��D�������������ڱ�״����Ϊ2.24L����B����E�������ı仯�ǣ�������
��ͼ��ʾ��A����ʯī�缫�������������Һ��B�ؾ�����ͭ��һ��ʱ���ֹͣͨ�磬A��D�������������ڱ�״����Ϊ2.24L����B����E�������ı仯�ǣ�������
 ��ͼ��ʾ��A����ʯī�缫�������������Һ��B�ؾ�����ͭ��һ��ʱ���ֹͣͨ�磬A��D�������������ڱ�״����Ϊ2.24L����B����E�������ı仯�ǣ�������
��ͼ��ʾ��A����ʯī�缫�������������Һ��B�ؾ�����ͭ��һ��ʱ���ֹͣͨ�磬A��D�������������ڱ�״����Ϊ2.24L����B����E�������ı仯�ǣ�������| A�� | ��������6.4 g | B�� | ��������12.8 g | C�� | ��������6.4 g | D�� | ��������12.8 g |
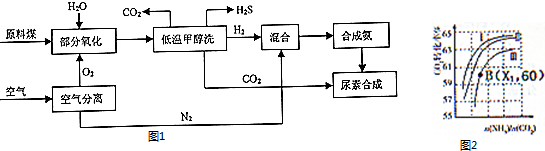
18�� ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
��ҵ������úת��ΪCO��������CO��ˮ������Ӧ��H2ʱ����������ƽ�⣺
CO��g��+H2O��g��?CO2��g��+H2��g��
��1����1L�����ܱ������г���CO��H2O��g����800��ʱ��ò����������±���
����¶��·�Ӧ��ƽ�ⳣ��K=1.2������ȷ��С�����һλ��
��2����ͬ�����£���2L�����ܱ������г���1mol CO��1mol H2O��g����2mol CO2��2mo1H2����ʱv��������v���棩���������=����������
����֪CO��g����H2��g����CH3OH��l����ȼ���ȷֱ�Ϊ283kJ•mol-1��286kJ•mol-1��726kJ•mol-1��
��3������CO��H2�ϳ�Һ̬�״����Ȼ�ѧ����ʽΪCO��g��+2H2��g��=CH3OH��l����H=-129kJ•mol-1��
��4�����ݻ�ѧ��Ӧԭ������������ѹǿ���Ʊ��״���Ӧ��Ӱ������ѹǿʹ��Ӧ���ʼӿ죬ͬʱƽ�����ƣ�CH3OH��������
��Ϊ���Ѷ�ʯ�͵Ĺ���������������Ա��úҺ���Ʊ����ͣ������������ȼ�ϵ�أ���ع���ԭ����ͼ��ʾ��һ���缫ͨ����������һ�缫ͨ������������������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-��
��5�������飨C8H18���������ͣ�д���õ�ع���ʱ�ĸ�����Ӧ����ʽC8H18-50e-+25O2-=8CO2+9H2O��
��6����֪һ�����ӵĵ�����1.602��10-19C���øõ�ص�ⱥ��ʳ��ˮ������·��ͨ��1.929��105C�ĵ���ʱ������NaOH80g��
����úȼ�ղ�����CO2���������ЧӦ����Ҫ����֮һ��
��7����CO2ת�����л������Ч��ʵ��̼ѭ�����磺
a.6CO2+6H2O$\stackrel{����/Ҷ����}{��}$C6H12O6+6O2 b.2CO2+6H2$��_{��}^{����}$C2H5OH+3H2O
c��CO2+CH4$��_{��}^{����}$CH3COOH d.2CO2+6H2$��_{��}^{����}$CH2=CH2+4H2O
���Ϸ�Ӧ�У�����ܵ���a����Ӧb��������ԭ��������Ϊ46%��
 ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã���ҵ������úת��ΪCO��������CO��ˮ������Ӧ��H2ʱ����������ƽ�⣺
CO��g��+H2O��g��?CO2��g��+H2��g��
��1����1L�����ܱ������г���CO��H2O��g����800��ʱ��ò����������±���
| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
��2����ͬ�����£���2L�����ܱ������г���1mol CO��1mol H2O��g����2mol CO2��2mo1H2����ʱv��������v���棩���������=����������
����֪CO��g����H2��g����CH3OH��l����ȼ���ȷֱ�Ϊ283kJ•mol-1��286kJ•mol-1��726kJ•mol-1��
��3������CO��H2�ϳ�Һ̬�״����Ȼ�ѧ����ʽΪCO��g��+2H2��g��=CH3OH��l����H=-129kJ•mol-1��
��4�����ݻ�ѧ��Ӧԭ������������ѹǿ���Ʊ��״���Ӧ��Ӱ������ѹǿʹ��Ӧ���ʼӿ죬ͬʱƽ�����ƣ�CH3OH��������
��Ϊ���Ѷ�ʯ�͵Ĺ���������������Ա��úҺ���Ʊ����ͣ������������ȼ�ϵ�أ���ع���ԭ����ͼ��ʾ��һ���缫ͨ����������һ�缫ͨ������������������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-��
��5�������飨C8H18���������ͣ�д���õ�ع���ʱ�ĸ�����Ӧ����ʽC8H18-50e-+25O2-=8CO2+9H2O��
��6����֪һ�����ӵĵ�����1.602��10-19C���øõ�ص�ⱥ��ʳ��ˮ������·��ͨ��1.929��105C�ĵ���ʱ������NaOH80g��
����úȼ�ղ�����CO2���������ЧӦ����Ҫ����֮һ��
��7����CO2ת�����л������Ч��ʵ��̼ѭ�����磺
a.6CO2+6H2O$\stackrel{����/Ҷ����}{��}$C6H12O6+6O2 b.2CO2+6H2$��_{��}^{����}$C2H5OH+3H2O
c��CO2+CH4$��_{��}^{����}$CH3COOH d.2CO2+6H2$��_{��}^{����}$CH2=CH2+4H2O
���Ϸ�Ӧ�У�����ܵ���a����Ӧb��������ԭ��������Ϊ46%��