题目内容
15.现有以下6种说法:①氯水、氨水、水玻璃、水银都是混合物;②明矾、冰醋酸、石膏都是电解质;③氯酸、烧碱、纯碱依次分别为酸、碱、盐;④${\;}_{1}^{1}$H+、${\;}_{1}^{2}$H+、${\;}_{1}^{3}$H+互为同位素;⑤胶体带电是电泳的前提条件;⑥生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品.其中不正确的是( )| A. | ①⑤ | B. | ①④⑤⑥ | C. | ②③④ | D. | ②⑤⑥ |
分析 ①水银为汞单质;
②明矾、冰醋酸、石膏分别为盐、酸,为电解质;
③氯酸属于酸,烧碱为氢氧化钠,纯碱为碳酸钠;
④同位素应为中子数不同的原子;
⑤胶体不带电;
⑥石英玻璃主要成分为二氧化硅.
解答 解:①氯水、氨水、水玻璃都为溶液,为混合物,而水银为汞单质,故错误;
②明矾、冰醋酸、石膏分别为盐、酸,为电解质,在水溶液里能电离出自由移动的阴阳离子导致溶液导电,故正确;
③氯酸属于酸,烧碱为氢氧化钠,纯碱为碳酸钠,依次分别为酸、碱、盐,故正确;
④同位素应为中子数不同的原子,${\;}_{1}^{1}$H+、${\;}_{1}^{2}$H+、${\;}_{1}^{3}$H+为离子,不是同位素,故错误;
⑤胶体呈电中性,不带电,故错误;
⑥石英玻璃主要成分为二氧化硅,不是硅酸盐,故错误.
故选B.
点评 本题考查混合物、电解质、同位素、化合物、弱电解质等概念,为高频考点,侧重于学生的分析能力的考查,题目较为简单,学习中注意对概念的理解要准确.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.2010年2月19日IUPAC(国际纯粹与应用化学联合会)宣布,第112号化学元素正式名称为“Copernicium”,元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165.下列关于Cn的说法正确的是( )
| A. | Cn是第六周期元素 | B. | Cn是过渡元素 | ||
| C. | Cn是非金属元素 | D. | Cn的一种核素可表示为165Cn |
10.氢元素存在1H、2H、3H三种核素,则自然界中的氢分子最多有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 9种 |
1.I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用.
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)+CH2═CH2(g)+4H2O(g)△H=a kJ•mol-1
已知:H2(g)的燃烧热为285.8kJ•mol-1,CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,H2O(g)=H2O(l)△H=-44.0kJ•mol-1,则a=-127.8kJ•mol-1.
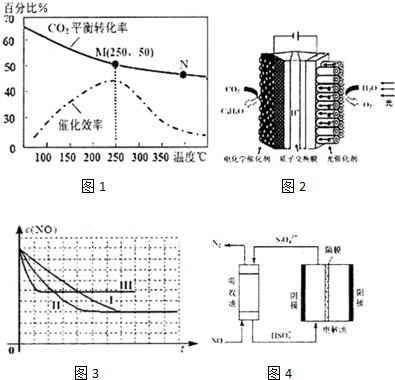
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图1,下列有关说法不正确的是①②④(填序号)
①温度越高,催化剂的催化效率越高
②温发低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”.如图2是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O.阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:2NO(g)+2CO(g)?2CO2(g)+N2(g).
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如3图:
①表中a=1.20×10-3.
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{c(NO)}{c(CO)}$=1,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,则K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$;.
(5)使用电化学法也可处理NO的污染,装置如图4.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.

(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)+CH2═CH2(g)+4H2O(g)△H=a kJ•mol-1
已知:H2(g)的燃烧热为285.8kJ•mol-1,CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,H2O(g)=H2O(l)△H=-44.0kJ•mol-1,则a=-127.8kJ•mol-1.
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图1,下列有关说法不正确的是①②④(填序号)
①温度越高,催化剂的催化效率越高
②温发低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”.如图2是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O.阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:2NO(g)+2CO(g)?2CO2(g)+N2(g).
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如3图:
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{c(NO)}{c(CO)}$=1,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,则K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$;.
(5)使用电化学法也可处理NO的污染,装置如图4.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.
8.控制变量法是研究化学变化量的重要思想方法.请仔细观察表中50mL稀盐酸和1g碳酸钙反应的实验数据:
(1)该反应属于放热反应(填“吸热”或“放热”).
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
| 实验 序号 | 碳酸钙 状态 | C(HCl)/mol•l-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
5.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F. | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940kJ•mol-1 | B. | 1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | 485kJ•mol-1 |
6.下列离子在酸性溶液中能够大量共存的是( )
| A. | CO32- | B. | Al3+ | C. | AlO2- | D. | HCO3- |