题目内容
3.工业上合成氨/合成尿素的一种工艺是以固体煤和焦炭为原料,采用气化的方法制取合成气,其流程图如图:回答以下问题:
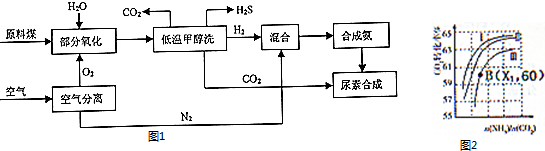
(1)将空气中的O2和N2分离主要是利用O2和N2沸点不同,空气分离过程中所涉及的实验操作名称是冷凝、分馏,该工业流程中可以重复利用的物质是CO2、H2O.(写化学式)
(2)低温甲醇洗主要是为了除去煤氧化过程中生成的CO2、H2S等杂质气体,若省略该步骤对后续合成氨的影响是会使催化剂中毒,失去活性.
(3)在低温甲醇洗的过程中一般分为两个阶段,第一阶段主要吸收H2S,第二阶段再吸收CO2,后续解离过程中则相反,先解离CO2,后解离H2S,甲醇在整个过程中几乎没有变化.设计该工艺流程顺序的主要原因是CO2和H2S在甲醇中的溶解度不同.
(4)①请写出合成尿素[CO(NH2)2]的化学方程式:2NH3+CO2?H2O+CO(NH2)2.
②工业生产时,原料气带有水蒸气,如图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系,曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ.
测得B点氨的转化率为30%,则x1=4.
分析 根据图1运用煤合成氨进而与二氧化碳合成尿素,煤合成氨工艺的核心问题是制备纯净的氢气,而制备纯净的氢气,就涉及到脱硫脱碳工序,含硫、含碳的气体,都是酸性气体.C+H2O=CO+H2,CO+H2O=CO2+H2运用低温甲醇洗除去CO2、H2S等杂质气体;利用O2和N2沸点不同分离O2和N2,再利用H2和N2合成氨气,再利用合成好的氨气和二氧化碳合成尿素;根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的;B点二氧化碳的转化率为60%,氨气的转化率是30%,设出NH3、CO2的起始物质的量,然后列式计算.
解答 解:(1)将空气中的O2和N2分离主要是利用O2和N2沸点不同,空气分离过程中所涉及的实验操作名称是冷凝、分馏,其中二氧化碳从甲醇中分离出来的CO2可用于尿素的合成,尿素合成生成的水可以用于煤的氧化过程,该工业流程中可以重复利用的物质是 CO2、H2O,故答案为:O2和N2沸点不同,冷凝、分馏,CO2、H2O;
(2)CO2、H2S等杂质气体会使催化剂中毒失去活性,故答案为:会使催化剂中毒,失去活性;
(3)在低温甲醇洗的过程中一般分为两个阶段,第一阶段主要吸收H2S,第二阶段再吸收CO2,后续解离过程中则相反,先解离CO2,后解离H2S,甲醇在整个过程中几乎没有变化.设计该工艺流程顺序的主要原因是CO2和H2S在甲醇中的溶解度不同,故答案为:CO2和H2S在甲醇中的溶解度不同;
(4)①合成尿素[CO(NH2)2]的化学方程式:2NH3+CO2?H2O+CO(NH2)2 故答案为:2NH3+CO2?H2O+CO(NH2)2;
②根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,则曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ曲线,
B点二氧化碳的转化率为60%,氨气的转化率是30%,
设NH3、CO2的起始物质的量分别为x、y,
则:x×30%×$\frac{1}{2}$=y×60%,
解得:$\frac{x}{y}$=x1=4,
故答案为:Ⅰ,4.
点评 本题考查运用煤合成尿素的流程题、注重工艺分析以及平衡图象的分析与判断,难度较大.侧重学生分析能力的考查.

| A. | 简单离子半径:Z>Y | B. | 阳离子的氧化性:X>Z | ||
| C. | 氧化物对应水化物的酸性:R>W | D. | X和Y只能形成一种化合物 |
| A. | HCl、Na2CO3 | B. | AlCl3、NaOH | C. | NaAlO2、HCl | D. | MgCl2、AgNO3 |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 9种 |
| A. | Cu是金属,可与稀硫酸反应制取氢气 | |
| B. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| C. | Cu(OH)2具有弱碱性,可用于治疗人体胃酸过多 | |
| D. | Fe3+具有氧化性,可溶解印刷线路板上的金属铜 |
| 实验 序号 | 碳酸钙 状态 | C(HCl)/mol•l-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
| A. | 该反应是一熵减反应 | |
| B. | 升高温度时,反应向逆方向进行 | |
| C. | 反应平衡时,v (CO2):v (CO)=1:2 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
| A. | 由红色变为深红色 | B. | 由无色变为深红色 | ||
| C. | 由浅红色变成深红色 | D. | 由无色变为浅红色 |
| A. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| B. | 制造新版人民币所使用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| C. | 为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于物理变化 |