题目内容
17.2,4,6-三甲基5-乙基辛烷的分子中共有6个甲基原子团.分析 根据名称可知主链两端各有1个甲基,支链上有3个甲基,1个乙基,乙基上含有1个甲基.
解答 解:由名称可知主链两端各有1个甲基,支链上有3个甲基,1个乙基,乙基上含有1个甲基,所以分子中共有6个甲基原子团;
故答案为:6.
点评 本题考查了烷烃的结构,题目难度中等,注意结构简式的书写是关键.

练习册系列答案
相关题目
8.控制变量法是研究化学变化量的重要思想方法.请仔细观察表中50mL稀盐酸和1g碳酸钙反应的实验数据:
(1)该反应属于放热反应(填“吸热”或“放热”).
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
| 实验 序号 | 碳酸钙 状态 | C(HCl)/mol•l-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
5.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F. | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940kJ•mol-1 | B. | 1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | 485kJ•mol-1 |
12.用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,使用酚酞做为指示剂,下列叙述中说明恰好达到滴定终点的是( )
| A. | 由红色变为深红色 | B. | 由无色变为深红色 | ||
| C. | 由浅红色变成深红色 | D. | 由无色变为浅红色 |
2.下列叙述能说明X的非金属性比Y强的是( )
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X原子的电子层数比Y原子的电子层数多 | |
| C. | Y的单质能将X从NaX的溶液中置换出来 | |
| D. | Y在暗处可与H2反应,X在加热条件下才能与H2反应 |
6.下列离子在酸性溶液中能够大量共存的是( )
| A. | CO32- | B. | Al3+ | C. | AlO2- | D. | HCO3- |
7.下列实验能成功的是( )
| A. | 用红外光谱来测定有机物分子中不同类型的氢原子和数目 | |
| B. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| C. | CH3CH2Cl与NaOH的乙醇溶液混合后加热,制得气体通入酸性高锰酸钾溶液中,若溶液褪色,则可检验气体中有乙烯 | |
| D. | 用酸性高锰酸钾溶液区分苯和甲苯 |
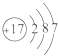 .
. (并用单线桥标出电子转移的方向和数目).
(并用单线桥标出电子转移的方向和数目).