题目内容
20.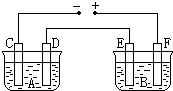 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A. | 质量增加6.4 g | B. | 质量增加12.8 g | C. | 质量减少6.4 g | D. | 质量减少12.8 g |
分析 由图可知,D、F为阳极,电解NaOH溶液,C为阴极发生2H++2e-=H2↑,D为Y阳极,电极反应为4OH--4e-=O2↑+2H2O,精炼粗铜,F为电解池的阳极,应为粗铜,E为电解池的阴极,为纯铜,电极反应为Cu2++2e-=Cu,结合电子守恒计算.
解答 解:由图可知,D、F为阳极,A池D极产生的气体在标准状况下为2.24L,D为Y阳极,电极反应为4OH--4e-=O2↑+2H2O,则n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
E为电解池的阴极,为纯铜,电极反应为Cu2++2e-=Cu,
由电子守恒可知,O2~4e-~2Cu,
则E极质量增加为0.1mol×2×64g/mol=12.8g,
故选B.
点评 本题考查电解原理及应用,为高频考点,把握电解判断、电极反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
10.氢元素存在1H、2H、3H三种核素,则自然界中的氢分子最多有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 9种 |
8.控制变量法是研究化学变化量的重要思想方法.请仔细观察表中50mL稀盐酸和1g碳酸钙反应的实验数据:
(1)该反应属于放热反应(填“吸热”或“放热”).
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
| 实验 序号 | 碳酸钙 状态 | C(HCl)/mol•l-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6表明温度 对反应速率的影响.
(3)从本实验数据中分析,影响化学反应速率的因素还有反应物接触面积,能表明这一规律的实验序号是1、2.
15.一定条件下,反应:C(s)+CO2(g)?2CO(g)在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40mol,则下列说法正确的是( )
| A. | 该反应是一熵减反应 | |
| B. | 升高温度时,反应向逆方向进行 | |
| C. | 反应平衡时,v (CO2):v (CO)=1:2 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
5.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F. | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940kJ•mol-1 | B. | 1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | 485kJ•mol-1 |
12.用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,使用酚酞做为指示剂,下列叙述中说明恰好达到滴定终点的是( )
| A. | 由红色变为深红色 | B. | 由无色变为深红色 | ||
| C. | 由浅红色变成深红色 | D. | 由无色变为浅红色 |
10.我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 反应物和生成物都是非极性分子 | |
| B. | 0.5molHCHO 含有1molσ键 | |
| C. | HCHO、CO2分子中中心原子杂化类型相 | |
| D. | 液态水中只存在一种作用力同 |

 .
. .
. .
. (并用单线桥标出电子转移的方向和数目).
(并用单线桥标出电子转移的方向和数目).