题目内容
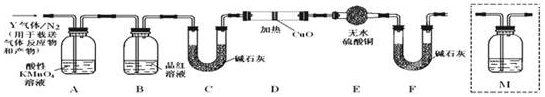
4.(1)一定条件下,16gA和22gB恰好反应生成C和4.5gD.在相同条件下,8gA和15gB反应可生成D和0.125molC.从上述事实可推知C的相对分子质量为134.(2)CO2气体中含有少量HCl杂质,除去该杂质所用的试剂最好是饱和NaHCO3溶液,实验所用的仪器为广口瓶、双孔塞、导气管,该操作方法称为洗气.
(3)含有相同分子个数的SO2和SO3,其质量比为4:5,物质的量比为1:1,其中所含氧原子个数比为2:3.
(4)人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用.在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的体积比是1:4,氧气的质量是1.6.
分析 (1)根据质量守恒定律计算16gA和22gB恰好反应生成C的质量,再根据质量定比关系计算8gA反应需要B的质量,判断A是否过量,再根据不足量的物质利用质量定比关系计算生成C的质量,根据M=$\frac{m}{M}$计算C的摩尔质量,摩尔质量在数值上等于相对分子质量;
(2)二氧化碳和饱和碳酸氢钠不反应,而氯化氢能反应,可用饱和碳酸氢钠溶液除去CO2气体中含有少量HCl杂质;
(3)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$,结合二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子解答;
(4)根据气体的体积和质量列方程式进行计算.
解答 解:(1)16gA恰好能跟22gB完全反应,生成0.25molC和和4.5gD,根据质量守恒,得出C的质量33.5g,C的摩尔质量为$\frac{33.5g}{0.25mol}$=134g/mol,则C相对分子质量为134,
故答案为:134;
(2)二氧化碳和饱和碳酸氢钠不反应,而氯化氢能反应,产生二氧化碳气体,可以用饱和NaHCO3溶液除去二氧化碳中混有的HCl,该方法为洗气,用到的仪器有:广口瓶、双孔塞、导气管,
故答案为:饱和NaHCO3溶液;广口瓶、双孔塞、导气管;洗气;
(3)依据n=$\frac{N}{{N}_{A}}$可知,含有相同分子个数的SO2和SO3,物质的量之比为:1:1;
依据n=$\frac{m}{M}$可知,相同物质的量的物质质量之比等于摩尔质量之比,所以物质的量之比为:1:1的SO2和SO3,质量之比=64:80=4:5;
二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子,则相同物质的量的SO2和SO3,其中所含氧原子个数比为2:3;
故答案为:4:5; 1:1;2:3;
(4)设氧气的物质的量是x,氦气的物质的量是y,则$\left\{\begin{array}{l}{x+y=\frac{5.6}{22.4}}\\{32x+4y=2.4}\end{array}\right.$,
解得:x=0.05mol、y=0.2mol,
相同条件下,氧气和氦气的体积之比等于其物质的量之比=0.05mol:0.2mol=1:4,氧气的质量为:0.05mol×32g/mol=1.6g,
故答案为:1:4;1.6.
点评 本题考查较为综合,涉及物质的分离与提纯、物质的量的计算、化学方程式的计算等知识,题目难度中等,明确物质的量与其它物理量之间的转化关系为解答关键,注意掌握常见物质分离与提纯方法,试题培养了学生的分析能力及化学实验、化学计算能力.

| A. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ | |
| D. | 反应放出的热量始终小于92.4 kJ |
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
Ⅰ.实验步骤:
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到容量瓶 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=$\frac{(15.95+15.00+15.05+14.95)}{4}$mL=15.24mL.指出他的计算的不合理之处:第1次滴定误差明显大,属异常值,应舍去.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的a(填写序号)
a.电离常数 b.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)ab.
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
KCl+Na $\stackrel{一定条件}{?}$ NaCl+K+Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气.
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是d.
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=$\frac{c(K)}{c(Na)}$.
I.一定条件下某密闭容器中可发生反应:aX2+bW2?cm,反应过程中物质的浓度变化如下:
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |


 ;
; ;
;
 .
.