题目内容
19.氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品.(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为2NH4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN-H、N-N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2,则反应放出(填“放出”或“吸收”)367kJ的能量.
(3)NH3-O2燃料电池的结构如图所示.

①a极为电池的负(填“正”或“负”)极.
②当生成1molN2时,电路中流过电子的物质的量为6mol.
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,该反应中氧化产物与还原产物的物质的量之比为1:1.
分析 (1)实验室是利用氯化铵与消石灰反应加热反应生成氨气;
(2)反应热=反应物总键能-生成物总键能;
(3)燃料电池中,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O;正极上氧气得电子生成氢氧根离子,正极反应为:O2+4e-+2H2O=4OH-;溶液中阴离子向负极移动,据此分析;
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,依据原子守恒和氧化还原反应中元素化合价变化计算氧化产物和还原产物物质的量之比.
解答 解:(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为:2NH4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:2NH4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN-H、N-N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2,反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)-946kJ/mol-4×3×390.8kJ/mol=-367KJ/mol,
故答案为:放出;367;
(3)该燃料电池中负极反应为:2NH3-6e-+6OH-═N2+6H2O,正极反应为:O2+4e-+2H2O=4OH-,则电池总反应为:4NH3+3O2═2N2+6H2O,
①a极通入燃料为负极,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O,
故答案为:负;
②负极反应为:2NH3-6e-+6OH-═N2+6H2O,生成1mol氮气单质转移6mol,故答案为:6mol;
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,反应的化学方程式为:N2H4+2NO=2N2+2H2O,反应中NO中氮元素化合价+2价变化为0价,得到还原产物,N2H4被氧化得到氮气为氧化产物,则反应中氧化产物与还原产物的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查热化学方程式书写、键能和反应的焓变计算、燃料电池的工作原理知识,注意知识的迁移应用是解题的关键,难度中等,明确原电池原理以及正负极的判断、电极方程式的书写是解题的关键.

 阅读快车系列答案
阅读快车系列答案 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
I.一定条件下某密闭容器中可发生反应:aX2+bW2?cm,反应过程中物质的浓度变化如下:
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图1所示:
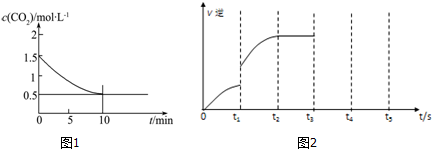
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2.
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是AC.
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.
| A. | 过氧化氢电子式: | B. | F-的结构示意图: | ||
| C. | 邻羟基苯甲酸的结构简式: | D. | 中子数为28的钙原子:${\;}_{20}^{28}$Ca |



 .
. .
. .
.