题目内容
7.在如图所示的装置中,a的金属活动性比氢强,b为碳棒,关于此装置的各种叙述不正确的是( )
| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极流向b极 | |
| D. | a极上发生了氧化反应 |
分析 a的活动性比氢要强,b为碳棒,该装置能自发的发生氧化还原反应而构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子放出氢气,所以碳棒上有气体放出,溶液中氢离子浓度减小,溶液的PH变大,故A正确;
B.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故B错误;
C.该装置能构成原电池,所以有电流产生,电子从负极a沿导线流向正极b,故C正确;
D.a作负极,负极上失电子发生氧化反应,故D正确;
故选:B.
点评 本题考查了原电池工作原理.原电池中正负极的判断不能仅凭金属的活泼性判断,要根据电极反应的反应类型、电子的流向等方面判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.如图为某种甲醇燃料电池示意图,工作是电子流动方向如图所示,下列判断正确的是( )
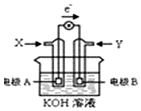

| A. | X位氧气 | |
| B. | 电极材料活泼性为:A>B | |
| C. | 电极B附近溶液碱性增强 | |
| D. | 电极A的反应式:CH3OH-6e-+H2O═CO2+6H+ |
18.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | NA个氢分子与NA个氧分子的质量比为1:1 | |
| B. | 1 mol氢气的质量与NA个氢分子的质量相等 | |
| C. | 16g氧气中含有的氧原子数为NA | |
| D. | 44g CO2与28g CO所含有的分子数均为NA |
15.已知Na2SO3溶液可与K2Cr2O7溶液反应,现有0.1mol/L的Na2SO3溶液12mL,恰好与0.04mol/L的K2Cr2O7溶液10mL完全反应,通过计算确定Cr元素在还原产物中的化合价( )
| A. | +1 | B. | +3 | C. | +4 | D. | +5 |
19.下列除去杂质(括号内的物质为杂质)的方法中错误的是( )
| A. | FeSO4 (CuSO4):加足量铁粉后,过滤 | |
| B. | CO (CO2):用NaOH溶液洗气后干燥 | |
| C. | CO2 (HCl):用NaOH溶液洗气后干燥 | |
| D. | MnO2 (KCl):加水溶解后,过滤、洗涤、烘干 |
16.下列表格中各项分类都正确的一组是( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯碱 | 冰水混合物 | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 乙醇 |
| C | 明矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | 氨水 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
 (1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为分子晶体.
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为分子晶体. 、④CH3-CH3这四种分子中碳原子采取sp2杂化的是①③(填序号).
、④CH3-CH3这四种分子中碳原子采取sp2杂化的是①③(填序号).