题目内容
17.如图为某种甲醇燃料电池示意图,工作是电子流动方向如图所示,下列判断正确的是( )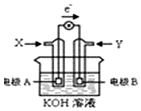
| A. | X位氧气 | |
| B. | 电极材料活泼性为:A>B | |
| C. | 电极B附近溶液碱性增强 | |
| D. | 电极A的反应式:CH3OH-6e-+H2O═CO2+6H+ |
分析 根据图片知,电解质溶液是碱性溶液,甲醇燃料电池中,通入甲醇的电极是负极,负极上失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,正极上是氧气发生得电子的还原反应,O2+4e-+2H2O=4OH-,电子是从负极流向正极,所以A是负极,B是正极,燃料电池的工作原理来回答.
解答 解:根据图片知,电解质溶液是碱性溶液,甲醇燃料电池中,电子是从负极流向正极,所以A是负极,B是正极,通入甲醇的电极是负极,X是甲醇,通氧气的电极是正极,Y是氧气.
A、X是甲醇、Y是氧气,故A错误;
B、在燃料点池中,电极的活泼性可以没有差距,只要能导电即可,故B错误;
C、B是正极,电极反应式为:O2+4e-+2H2O=4OH-,电极附近溶液pH增大,所以碱性增强,故C正确;
D、负极A上发生失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,故D错误、
故选C.
点评 本题考查了化学电源新型电池,根据正负极上得失电子及电极反应式来分析解答,并结合转移电子相等进行计算,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
18.下列有关溶液的存储和配制的描述不正确的是( )
| A. | 氨水易挥发,应密封在低温处保存 | |
| B. | 水玻璃可存放在橡胶塞的细口瓶中 | |
| C. | 配制FeCl3溶液,先加浓盐酸溶解氯化铁固体,再稀释至相应浓度 | |
| D. | 称取2.5g硫酸铜晶体,溶于l00mL水中可以配制物质的量浓度为0.1mol•L-1的硫酸铜溶液 |
19.下列实验装置设计正确、且能达到目的是( )
| A. |  用于除去CO2中的HCl | B. |  排水法收集NO | ||
| C. |  配制一定物质的量浓度的稀硫酸 | D. |  海水的淡化 |
12.下列除杂试剂的选择和除杂后检验杂质是否除尽的方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 检验方法 |
| A | CO2(SO2) | 饱和NaHSO3溶液 | 将已除杂质的少量气体通入品红溶液 |
| B | NaHCO3溶液(Na2CO3) | 过量CO2 | 取少量溶液,加入Ca (OH)2溶液,观察现象 |
| C | NO(NO2) | 水 | 观察颜色 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液 | 将已除杂质的少量气体通入溴水 |
| A. | A | B. | B | C. | C | D. | D |
9.某原子的摩尔质量是Mg•mol-1,则一个该原子的真实质量是( )
| A. | $\frac{M}{6.02×1{0}^{23}}$g | B. | $\frac{1}{M}$ g | C. | M g | D. | $\frac{6.02×1{0}^{23}}{M}$ g |
6.下列离子方程式书写正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 醋酸与烧碱溶液反应:H++OH-═H2O | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | 硫酸与氨水混合:H++NH3•H2O═NH4++H2O |
7.在如图所示的装置中,a的金属活动性比氢强,b为碳棒,关于此装置的各种叙述不正确的是( )

| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极流向b极 | |
| D. | a极上发生了氧化反应 |